
【题目】2013年诺贝尔化学奖授予三位美国科学家,以表彰他们如光合作用叶绿体光反应时酶中、生物固氮时固氮酶中)的化学反应。
(1)固氮酶有铁蛋白和钒铁蛋白两种,它们不仅能够催化N2还原成NH3,还能将环境底物乙炔催化还原成乙烯,下列说法正确的有________(不定项选择)。
a.C2H2、C2H4都是非极性分子
b.碳负离子CH![]() 呈三角锥形
呈三角锥形
c.NO+电子式为[∶NO∶]+
d.NH3沸点比N2高,主要是因为前者是极性分子
(2)钒可合成电池电极,也可人工合成二价钒(V)固氮酶(结构如图)
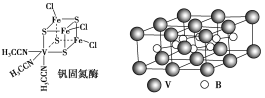
①V2+基态时核外电子排布式为______________________________________。
②钒固氮酶中钒的配位原子有________(写元素符号)。
③熔融空气电池钒硼晶体晶胞结构如图所示,该晶胞中含有钒原子数目为________。
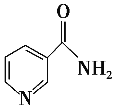
(3)烟酰胺(结构简式如图)可用于合成光合辅酶NADPH,烟酰胺分子中氮原子的杂化轨道类型有________,1 mol该分子中含σ键的数目为__________________________________。
【答案】(1)abc
(2)①1s22s22p63s23p63d3或[Ar]3d3 ②S、N ③4
(3)sp2、sp3 15NA(或15×6.02×1023)
【解析】(1)乙烯、乙炔均为非极性分子,a正确;碳负离子CH![]() 与NH3互为等电子体,故CH
与NH3互为等电子体,故CH![]() 呈三角锥形,b正确;NO+与N2互为等电子体,故NO+的电子式为[∶NO∶]+,c正确;氨气的沸点比氮气高的主要原因是氨气分子间存在氢键,d错误。
呈三角锥形,b正确;NO+与N2互为等电子体,故NO+的电子式为[∶NO∶]+,c正确;氨气的沸点比氮气高的主要原因是氨气分子间存在氢键,d错误。
(2)①V的原子序数为23,V2+基态时核外电子排布式为1s22s22p63s23p63d3或[Ar]3d3。②根据钒固氮酶的结构示意图可知钒固氮酶中钒的配位原子有S和N两种。③根据钒硼晶体晶胞中钒原子所处的位置和分摊法计算,该晶胞中含有的钒原子数目为: 8×![]() +8×
+8×![]() +2×
+2×![]() =4。
=4。
(3)根据烟酰胺的结构简式可知其分子中氮原子的杂化轨道类型有两种,分别为sp2和sp3杂化。根据分子结构以及单键、双键所含σ键的规律可知。1 mol该分子中含15 mol σ键。


 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案科目:高中化学 来源: 题型:
【题目】下列有关物质用途的说法,不正确的是( )
A.高纯度的硅单质广泛用于制作光导纤维
B.钠可用于冶炼金属钛
C.小苏打可用于治疗胃酸过多
D.过氧化钠可用于潜水艇的氧气来源
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式中,只能表示一个化学反应的是( )
①CO32-+2H+=CO2↑+H2O
②Ba2++2OH-+2H++SO=BaSO4↓+2H2O
③Ag++Cl-=AgCl↓
④Fe+Cu2+=Fe2++Cu
⑤Cl2+H2O=H++Cl-+HClO
A.①③
B.②④
C.②⑤
D.只有⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.糖类化合物都具有相同的官能团
B.酯类物质是形成水果香味的主要成分
C.油脂的皂化反应生成脂肪酸和丙醇
D.蛋白质的水解产物都含有羧基和羟基
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中正确的是( )
A.凡是盐在离子方程式中都要以离子的形式来表示
B.离子反应一定使溶液中所有离子的浓度都发生变化
C.复分解反应必须具备离子反应的某个条件
D.酸碱中和反应都能用离子方程式:H++OH-=H2O表示
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质混合后,不会发生离子反应的是( )
A.NaOH溶液和FeCl3溶液
B.Na2CO3溶液和稀硫酸
C.Na2SO4溶液和MgCl2溶液
D.CuSO4溶液和Ba(OH)2溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式中正确的是( )
A.澄清石灰水与稀盐酸反应Ca(OH)2+2H+=Ca2++2H2O
B.氢氧化钡与硫酸反应OH-+H+=H2O
C.铜片插入硝酸银溶液中Cu+Ag+=Cu2++Ag
D.氯化镁溶液与氢氧化钠溶液反应Mg2++2OH-=Mg(OH)2↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了配制NH4+的浓度与Cl-的浓度比为1:1的溶液,可在NH4Cl溶液中加入:( )
①适量的HCl; ②适量的NaCl; ③适量的氨水; ④NaOHA、①② B、③ C、③④ D、④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com