
| A. | 氯乙烷与NaOH溶液共热,在反应后的溶液中加入AgNO3溶液检验Cl- | |
| B. | 在淀粉加入硫酸加热水解后的溶液中,直接加入银氨溶液,水浴加热,检验葡萄糖的生成 | |
| C. | 1 mol•L-1 CuSO4溶液2 mL和0.5 mol•L-1 NaOH溶液4 mL混合后加入40%的乙醛溶液0.5 mL,加热煮沸观察沉淀的颜色 | |
| D. | 除去乙烯中杂质气体:将实验室制得的乙烯气体通入NaOH 溶液 |
分析 A.氯乙烷与NaOH溶液共热,发生水解反应,但检验氯离子应在酸性条件下;
B.淀粉加入硫酸加热水解后的溶液中含葡萄糖,但检验葡萄糖应在碱性条件下;
C.1 mol•L-1 CuSO4溶液2 mL和0.5 mol•L-1 NaOH溶液4 mL混合后,碱不足,且乙醛与氢氧化铜的反应在碱性条件下发生;
D.利用乙醇发生消去反应制备乙烯中混有杂质乙醇、还可能含二氧化碳、二氧化硫等.
解答 解:A.氯乙烷与NaOH溶液共热,发生水解反应,但检验氯离子应在酸性条件下,则没有先加硝酸至酸性,再加硝酸银,不能检验,故A错误;
B.淀粉加入硫酸加热水解后的溶液中含葡萄糖,但检验葡萄糖应在碱性条件下,则应先加碱至碱性,再加银氨溶液,故B错误;
C.1 mol•L-1 CuSO4溶液2 mL和0.5 mol•L-1 NaOH溶液4 mL混合后,碱不足,且乙醛与氢氧化铜的反应在碱性条件下发生,则该实验中不能观察到砖红色沉淀,故C错误;
D.利用乙醇发生消去反应制备乙烯中混有杂质乙醇、还可能含二氧化碳、二氧化硫等,则将实验室制得的乙烯气体通入NaOH 溶液可除杂,故D正确;
故选D.
点评 本题考查化学实验方案的评价,为高频考点,把握有机物的性质、发生的反应、混合物分离提纯为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,选项C为解答的易错点,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 石油分馏可得到汽油、煤油和柴油等产品 | |
| B. | 石油的催化重整可得到芳香烃 | |
| C. | 石油裂解主要是为了得到更多的汽油 | |
| D. | 煤、石油、天然气是不可再生的一次能源 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
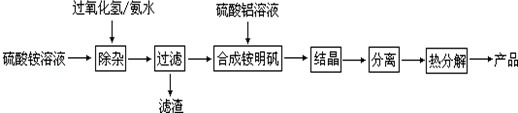
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 玻璃、水泥、水晶都是硅酸盐制品 | |
| B. | 将秸秆焚烧可得富含钾肥的草木灰,焚烧是一种较为理想的秸秆处理办法 | |
| C. | 石油的分馏和煤的气化、液化,涉及的都是物理变化 | |
| D. | 纤维素不能被人体消化吸收,但能促进肠道的蠕动,对人体有益 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 某研究性学习小组欲测定室温下(25℃、101kPa)的气体摩尔体积.该小组设计的简单实验装置如图所示:该实验的主要操作步骤如下:
某研究性学习小组欲测定室温下(25℃、101kPa)的气体摩尔体积.该小组设计的简单实验装置如图所示:该实验的主要操作步骤如下:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该晶体属于分子晶体,可用作制冷材料 | |
| B. | 该晶体中碳原子在空间的分布结构与金刚石相似 | |
| C. | 该晶体的熔点低于二氧化硅 | |
| D. | 1mol 晶体中含 4 mol C-O 键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com