
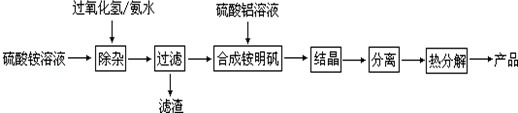
分析 由工艺流程可知,加入过氧化氢将溶液中Fe2+氧化为Fe3+,加入氨水调节溶液PH值,Fe3+使转化为Fe(OH)3,过滤后滤液主要含硫酸铵,再将硫酸铵和硫酸铝溶液混合反应,经蒸发浓缩、冷却结晶、过滤、洗涤、干燥等最终得到硫酸铝铵晶体,硫酸铝铵晶体热分解得到氧化铝,
(1)H2O2溶液具有强氧化性,可以氧化亚铁离子生成铁离子,铁离子在氨水存在的条件下生成氢氧化铁红褐色沉淀;
(2)铝离子在溶液中能够发生水解生成氢氧化铝;
(3)将晶体与溶液分离的操作是过滤;
(4)根据题中所给的化学式,利用铵根和铝离子水解进行解答即可;
(5)6NH4Al(SO4)2═3Al2O3+2NH3↑+2N2↑+6SO2↑+6SO3↑+9H2O,反应中氮元素化合价-3价变化为0价,硫元素化合价+6价变化为+4价,生成3molAl2O3 电子转移12e-;
(6)往含0.1mol铵明矾稀溶液中逐滴加入含0.3mol Ba(OH)2的稀溶液,按照1:3反应,铵根离子结合一个氢氧根离子生成氨气和水,硫酸根离子结合2个钡离子生成硫酸钡沉淀,一个铝离子结合4个氢氧根离子生成偏铝酸盐和水,氢氧根离子剩余.
解答 解:(1)H2O2溶液具有强氧化性,可以氧化亚铁离子生成铁离子,则Fe2+酸性条件下氧化为Fe3+的离子方程式为:2Fe2++H2O2+2H+═2Fe3++2H2O,
故答案为:2Fe2++H2O2+2H+═2Fe3++2H2O;
(2)由于铝离子在溶液中能够发生水解生成氢氧化铝,所以加入硫酸酸化,抑制了铝离子的水解,
故答案为:抑制Al3+水解;
(3)通过过滤,将硫酸铝晶体从溶液中分离,所以C正确,
故选C;
(4)铵明矾晶体的化学式为NH4Al(SO4)2•12H2O,是一种物质组成的为纯净物,在0.1mol/L铵明矾的水溶液中,未水解前,c(Al3+)=c(NH4+)=0.1mol/L,由于铵根和铝离子均水解,水解结合水电离出的氢氧根,故水解后浓度均小于0.1mol/L,c(SO42-)=0.2mol/L,浓度最大的离子是
SO42-,
故答案为:SO42-;
(5)6NH4Al(SO4)2═3Al2O3+2NH3↑+2N2↑+6SO2↑+6SO3↑+9H2O,反应中氮元素化合价-3价变化为0价,硫元素化合价+6价变化为+4价,生成3molAl2O3 电子转移12e-,当生成1mol Al2O3时转移电子物质的量为4mol,
故答案为:4;
(6)往含0.1mol铵明矾稀溶液中逐滴加入含0.3mol Ba(OH)2的稀溶液,按照1:3反应,铵根离子结合一个氢氧根离子生成一水合氨,硫酸根离子结合2个钡离子生成硫酸钡沉淀,一个铝离子结合4个氢氧根离子生成偏铝酸钡和水,氢氧根离子剩余,反应的离子方程式为:NH4++Al3++2SO42-+2Ba2++5OH-═NH3•H2O+AlO2-+2BaSO4↓+2H2O,
故答案为:NH4++Al3++2SO42-+2Ba2++5OH-═NH3•H2O+AlO2-+2BaSO4↓+2H2O.
点评 本题考查工艺流程、离子检验、盐类水解、对条件的控制选择、物质的分离提纯等,理解工艺流程原理是解题的关键,是对学生综合能力的考查,需要学生具备扎实的基础与灵活运用能力,题目难度中等.


科目:高中化学 来源: 题型:填空题
 ⑧
⑧ ⑨C60
⑨C60查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 原子半径的大小顺序:r(Z)>r(W)>r(Y)>r(X) | |
| B. | 元素Y的简单气态氢化物的热稳定性比W的弱 | |
| C. | 化合物Z2Y2与X2Y反应时,Z2Y2既是氧化剂又是还原剂 | |
| D. | 由X、Y、Z、W四种元素组成的两种化合物不能发生化学反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{22.4ab}{a{N}_{A}}$ | B. | $\frac{22.4ac}{b{N}_{A}}$ | C. | $\frac{22.4bc}{a{N}_{A}}$ | D. | $\frac{22.4b}{ac{N}_{A}}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 不变 | B. | 增大 | C. | 减小 | D. | 无法判断 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯乙烷与NaOH溶液共热,在反应后的溶液中加入AgNO3溶液检验Cl- | |
| B. | 在淀粉加入硫酸加热水解后的溶液中,直接加入银氨溶液,水浴加热,检验葡萄糖的生成 | |
| C. | 1 mol•L-1 CuSO4溶液2 mL和0.5 mol•L-1 NaOH溶液4 mL混合后加入40%的乙醛溶液0.5 mL,加热煮沸观察沉淀的颜色 | |
| D. | 除去乙烯中杂质气体:将实验室制得的乙烯气体通入NaOH 溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 纤维素、蔗糖、葡萄糖和脂肪在一定条件下都可发生水解反应 | |
| B. | 油脂都不能使溴的四氯化碳溶液褪色 | |
| C. | 石油分馏、煤的干馏均为物理变化 | |
| D. | 淀粉、蛋白质和天然橡胶均是天然高分子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com