
分析 (1)n(CO2)=$\frac{8.8g}{44g/mol}$=0.2mol,n(H2O)=$\frac{5.4g}{18g/mol}$=0.3mol,n(O2)=$\frac{6.72L}{22.4L/mol}$=0.3mol,结合质量守恒定律推断;
(2)质谱仪测定有机化合物的相对分子质量为46,结合最简式判断分子式为C2H6O;
(3)A可能为乙醇或二甲醚;
(4)有机物A能与金属钠反应,说明含羟基;
(5)A的同分异构体为乙醇,在一定条件下脱水可生成B,B为CH2=CH2,乙烯与氯化氢在催化作用下加成可生成氯乙烷.
解答 解:(1)n(CO2)=$\frac{8.8g}{44g/mol}$=0.2mol,n(H2O)=$\frac{5.4g}{18g/mol}$=0.3mol,n(O2)=$\frac{6.72L}{22.4L/mol}$=0.3mol,则有机物中含n(O)=0.2mol×2+0.3mol-0.6mol=0.1mol,则有机物中N(C):N(H):N(O)=0.2mol:0.6mol:0.1mol=2:6:1,
最简式为C2H6O,
故答案为:n(C):n(H):n(O)=2:6:1;
(2)最简式为C2H6O,有机化合物的相对分子质量为46,则该物质的分子式是C2H6O,故答案为:C2H6O;
(3)A可能为乙醇或二甲醚,结构简式为CH3CH2OH、CH3-O-CH3,故答案为:CH3CH2OH、CH3OCH3;
(4)有机物A能与金属钠反应,说明说明有机物分子中含一个活泼氢原子,应含羟基,应为乙醇,结构简式为CH3CH2OH,
故答案为:C2H5OH; 2mol有机物与钠反应生成1摩H2,说明有机物分子中含一个活泼;
(5)A的同分异构体为乙醇,在一定条件下脱水可生成B,B为,乙烯与氯化氢在催化作用下加成可生成氯乙烷,反应的相关方程式为CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O、CH2=CH2 +HCl$\stackrel{催化剂}{→}$CH3CH2 Cl.
故答案为:CH2=CH2 +HCl$\stackrel{催化剂}{→}$CH3CH2 Cl.
点评 本题考查有机物的推断,题目难度不大,本题注意根据生成5.4gH2O和8.8gCO2,消耗氧气6.72L,从质量守恒的角度判断有机物最简式,为解答该题的关键,注意把握题给信息.


 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石油分馏可得到汽油、煤油和柴油等产品 | |
| B. | 石油的催化重整可得到芳香烃 | |
| C. | 石油裂解主要是为了得到更多的汽油 | |
| D. | 煤、石油、天然气是不可再生的一次能源 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
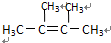 .
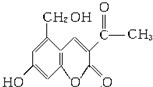
.
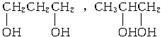
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
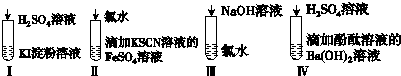
| 选项 | 现象 | 离子方程式 |
| A | I在空气中放置一段时间后,溶液呈蓝色 | 4I-+O2+2H2O═2I2+4OH- |
| B | II溶液由浅绿色变为红色 | Fe2++Cl2═Fe3++2Cl- Fe3++3SCN-═Fe(SCN)3 |
| C | III溶液 颜色无变化 | Cl2+2OH-═Cl-+ClO-+H2O |
| D | IV有白色沉淀生成,溶液由红色变无色 | Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe3+、Al3+、Br-、SO42- | B. | Na+、K+、OH-、SiO32- | ||
| C. | Ca2+、K+、Br-、Cl- | D. | Li+、H+、NO3-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
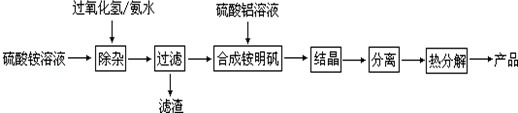
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com