
【题目】下列化学原理正确的是( )
A. 沸点:HF>HCl>HBr>HI
B. 一定条件下![]() 可以自发进行,则
可以自发进行,则![]()
C. 常温下,![]() 溶液加水,水电离的
溶液加水,水电离的![]() 保持不变
保持不变
D. 标况下,1mol![]() 分别与足量Na和
分别与足量Na和![]() 反应,生成气体的体积比为
反应,生成气体的体积比为![]()
【答案】B
【解析】
A. HF分子间存在氢键,沸点最高,HCl、HBr、HI的沸点随相对分子质量增大,分子间作用力增大,沸点升高,所以沸点:HF>HI>HBr>HCl,故A错误;
B. 反应4NO2(g)+O2(g)![]() 2N2O5(g)可以自发进行,则
2N2O5(g)可以自发进行,则![]() H-T
H-T![]() S<0,由于该反应气体分子数减小,
S<0,由于该反应气体分子数减小,![]() S<0,则
S<0,则![]() ,故B正确;
,故B正确;
C. CH3COO-水解促进水的电离,CH3COONa溶液加水则CH3COO-浓度减小,对水的电离促进作用减小,水电离的c(H+)![]() c(OH-)减小,故C错误;
c(OH-)减小,故C错误;
D. 酚羟基和羧基都能和Na反应生成H2,而NaHCO3只能与羧基反应生成CO2,所以1mol![]() 分别与足量Na和NaHCO3反应,生成气体的体积比为1:1,故D错误。
分别与足量Na和NaHCO3反应,生成气体的体积比为1:1,故D错误。
答案选B。


科目:高中化学 来源: 题型:
【题目】某研究小组以化合物1为原料,按下列路线制备聚合物8。

已知:R—X![]() R—CN
R—CN![]() R—COOH
R—COOH
R—CH2COOH![]()
![]()
请回答:
(1)以下四个化合物中,含有羧基的是
A.化合物3 B.化合物4 C.化合物6 D.化合物7
(2)化合物4→8的合成路线中,未涉及的反应类型是
A.取代反应 B.消去反应 C.加聚反应 D.还原反应
(3)下列四个化合物中,与化合物4互为同系物的是
A.CH3COOC2H5B.C6H5COOH
C.CH3CH2CH2COOH D.CH3COOH
(4)化合物4的属于酯类的所有同分异构体的结构简式 。
(5)化合物7→8的化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】门捷列夫在研究周期表时预言了包括“类铝”、“类硅”在内的11种元素。
(1)门捷列夫预言的“类硅”,多年后被德国化学家文克勒发现,命名为锗(Ge)。
①已知主族元素锗的最高化合价为+4价,其最高价氧化物的水化物为两性氢氧化物。试比较元素的非金属性Si___ Ge(用“>”或“<”表示)。
②若锗位于Si的下一周期,写出“锗”在周期表中的位置_____。根据锗在周期表中处于金属和非金属分界线附近,预测锗单质的一种用途是_______.
③硅和锗单质分别与![]() 反应时,反应较难进行的是_______(填“硅”或“锗”)。
反应时,反应较难进行的是_______(填“硅”或“锗”)。
(2)“类铝”在门捷列夫预言4年后,被布瓦博德朗在一种矿石中发现,命名为镓(Ga)。
①由镓的性质推知,镓与铝同主族,且位于铝的下一周期。试写出镓原子的结构示意图____。冶炼金属镓通常采用的方法是_____.
②已知Ga(OH)3难溶于水,为判断Ga(OH)3是否为两性氢氧化物,设计实验时,需要选用的试剂有GaCl3溶液、________和________.
(3)某同学阅读课外资料,看到了下列有关锗、锡、铅三种元素的性质描述:
①锗、锡在空气中不反应,铅在空气中表面形成一层氧化铅;
②锗与盐酸不反应,锡与盐酸反应,铅与盐酸反应但生成PbCl2微溶而使反应终止:
该同学查找三种元素在周期表的位置如图所示:
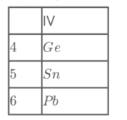
根据以上信息推测,下列描述正确的是______(填标号)。
a.锗、锡、铅的+4价的氢氧化物的碱性强弱顺序是:Ge(OH)4<Sn(OH)4<Pb(OH)4
b.锗、锡、铅的金属性依次减弱;
c. 锗、锡、铅的原子半径依次增大。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有A、B、C、D、E五种元素,它们的质子数依次增多。
①A的核电荷数大于2,可形成氢化物H2A,该氢化物在常温下是液体;
②A和B两元素可形成B2A3化合物,该化合物既能溶于强酸,又能溶于强碱;
③C+离子比B3+离子多8个电子;
④C与D元素可以形成化合物CD;
⑤CD的溶液中通入氯气后加淀粉溶液显蓝色;
⑥E、C同主族,且E比C多两个电子层,E单质可与冷水反应生成氢气。
试回答:
(1)写出元素C、E的名称:C______;E______。
(2)画出A的原子结构示意图______,B的离子结构示意图______,D的单质分子的电子式______。
(3)写出B2A3分别与盐酸和氢氧化钠溶液反应的离子方程式:
____________________;___________________。
(4)比较B、C、E三种元素形成的简单离子半径的大小和氧化性的强弱(用离子符号表示):离子半径:_____________;氧化性:____________。
(5)写出E与冷水反应的化学方程式:_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】创建文明校园,学校全园禁烟,同学们也参与了“寻找烟头”活动。吸烟有害健康,烟草中的剧毒物尼古丁的结构简式为 ,有关其叙述正确的是
,有关其叙述正确的是
A. 该有机物属于芳香族化合物
B. 尼古丁分子中的C、N原子均处于同一平面内
C. 尼古丁分子中的六元环不是正六边形
D. 尼古丁的一氯代物有10种同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列表示对应化学反应的离子方程式正确的是 ( )
A.将 CO2 通入 CaCl2 溶液:CO2+H2O+Ca2+=CaCO3↓+2H+
B.往氢氧化钠溶液中通入过量 SO2:OH- + SO2 =![]()
C.向氢氧化亚铁中加入足量的稀硝酸:Fe(OH)2+2H+=Fe2++2H2O
D.向 Ba(OH)2 溶液中滴加NaHSO4 溶液至中性:Ba2++OH-+H++![]() ═BaSO4↓+H2O
═BaSO4↓+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NO、CO、![]() 是大气污染物但又有着重要用途。
是大气污染物但又有着重要用途。
已知:![]()
![]()
![]()
![]()
![]()
![]()
(1)某反应的平衡常数表达式为 ,此反应的热化学方程式为:______。
,此反应的热化学方程式为:______。
(2)向绝热恒容密闭容器中充入等量的NO和CO进行反应,能判断反应已达到化学平衡状态的是______(填序号)。
a.容器中的压强保持不变 b.![]()
c.气体的平均相对分子质量保持34.2不变 d.该反应平衡常数保持不变
e.NO和CO的体积比保持不变
Ⅱ.(3)甲烷转化为![]() 和CO的反应为:
和CO的反应为:![]()
![]()

①一定条件下,![]() 的平衡转化率与温度、压强的关系如图所示。则
的平衡转化率与温度、压强的关系如图所示。则![]() ______
______![]() (填“<”“>”或“=”);
(填“<”“>”或“=”);
A、B、C三点处对应的平衡常数(![]() 、
、![]() 、
、![]() ),由大到小的顺序为______。
),由大到小的顺序为______。
②将![]() 和
和![]() 按等物质的量混合,一定条件下反应达到平衡,
按等物质的量混合,一定条件下反应达到平衡,![]() 转化率为50%。则反应前与平衡后,混合气体的平均相对分子质量之比为______。
转化率为50%。则反应前与平衡后,混合气体的平均相对分子质量之比为______。
Ⅲ.含![]() 的烟气可用
的烟气可用![]() 溶液吸收。
溶液吸收。
(4)已知![]() 时由
时由![]() ,和
,和![]() 形成的混合溶液恰好呈中性,此时溶液中离子浓度大小顺序为______。(已知
形成的混合溶液恰好呈中性,此时溶液中离子浓度大小顺序为______。(已知![]() 时,
时,![]() 的电离平衡常数
的电离平衡常数![]() ,
,![]() )
)
(5)可将吸收液送至电解槽再生后循环使用。再生电解槽如图所示。a电极上含硫微粒放电的反应式为______(任写一个)。离子交换膜______(填标号)为阴离子交换膜。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机化合物A~H的转换关系如下所示:

请回答下列问题:
(1)链烃A有支链且只有一个官能团,其相对分子质量在65~75之间,1 mol A完全燃烧消耗7 mol氧气,则A的结构简式是____________________________。
(2)在特定催化剂作用下,A与等物质的量的H2反应生成E。E______(填“存在”或“不存在”)顺反异构,由E转化为F的化学方程式为______________________________。
(3)G与金属钠反应能放出气体,由F转化为G的反应条件是__________________;由G生成H的化学方程式是__________________。
(4)B是A的一种同分异构体,它的一氯代物只有一种(不考虑立体异构),则B的结构简式为________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】针对下列实验现象表述不正确的是
A. 用同一针筒先后抽取80 mL氯气、20 mL水,振荡,气体完全溶解,溶液变为黄绿色
B. 在表面皿中加入少量胆矾,再加入3 mL浓硫酸,搅拌,固体由蓝色变白色
C. 向二氧化硫水溶液中滴加氯化钡溶液,再滴加双氧水,产生白色沉淀
D. 将点燃后的镁条伸入充满二氧化碳的集气瓶,镁条剧烈燃烧,有白色、黑色固体生成
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com