
【题目】已知![]() 、
、![]() 、
、![]() (z)互为同分异构体,下列说法不正确的是( )
(z)互为同分异构体,下列说法不正确的是( )
A.z的二氯代物有3种
B.x、y的一氯代物均只有3种
C.x、y因与Br2发生加成反应而使溴的四氯化碳溶液褪色
D.x、y、z中只有x的所有原子可能处于同一平面
 作业辅导系列答案
作业辅导系列答案 同步学典一课多练系列答案
同步学典一课多练系列答案 经典密卷系列答案
经典密卷系列答案 金牌课堂练系列答案
金牌课堂练系列答案科目:高中化学 来源: 题型:
【题目】常温下,向20 mL 0.1mol·L-1的盐酸中逐滴加入0.1 mol·L-1的氨水,溶液pH的变化与加入氨水的体积关系如图所示。下列叙述不正确的是
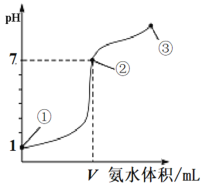
A.V>20 mL
B.①、②、③点水的电离程度大小为:②>③>①
C.在点②所示溶液中:c(Cl-)=c(NH3·H2O)+c(NH![]() )
)
D.在点②、③之间可能存在:c(NH![]() )>c(Cl-)=c(OH-)>c(H+)
)>c(Cl-)=c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中可能大量共存的是
A.澄清透明的溶液中: Fe3+、Mg2+、SCN-、Cl-
B.由水电离产生的c(H+)= 10-13mol/L 的溶液: K+、Na+、CH3COO-、![]()
C.c(Fe2+)= 1mol/L的溶液中: H+、![]() 、
、![]() 、
、![]()
D.pH=1的溶液中: Ba2+、Mg2+、![]() 、
、![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各项比较中前者高于(或大于或强于)后者的是
A. 金属Mg(六方最密堆积)和金属Cu(面心立方最密堆积)的空间利用率
B. BF3和CH4中心原子的价层电子对数
C. Si-O和C-O的键能
D. 对羟基苯甲醛(![]() )和邻羟基苯甲醛(
)和邻羟基苯甲醛(![]() )的沸点
)的沸点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由CH3CH2CH2Br制备CH3CH(OH)CH2OH,依次从左至右发生的反应类型和反应条件都正确的是 ( )
选项 | 反应类型 | 反应条件 |
A | 加成反应;取代反应;消去反应 | KOH醇溶液 |
B | 消去反应;加成反应;取代反应 | NaOH水溶液 |
C | 氧化反应;取代反应;消去反应 | 加热;KOH醇溶液 |
D | 消去反应;加成反应;水解反应 | NaOH醇溶液 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.氟及其化合物用途非常广泛。回答下列问题:
(1)聚四氟乙烯商品名称为“特氟龙”,可做不粘锅涂层。它是一种准晶体,该晶体是一种无平移周期序、但有严格准周期位置序的独特晶体。可通过____________方法区分晶体、准晶体和非晶体。
(2)锑(Sb)与砷处于同一主族且相邻,基态锑原子价电子排布式为______。[H2F]+[SbF6]-(氟酸锑)是一种超强酸,存在[H2F]+,写出一种与[H2F]+互为等电子体的阴离子是_________。
(3)硼酸(H3BO3)和四氟硼酸铵(NH4BF4)都有着重要的化工用途。
①H3BO3和NH4BF4涉及的四种元素中第二周期元素的第一电离能由大到小的顺序____(填元素符号)。
②H3BO3本身不能电离出H+,在水中易结合一个OH﹣生成[B(OH)4]﹣,而体现弱酸性。[B(OH)4]﹣中B原子的杂化类型为_________。
③NH4BF4(四氟硼酸铵)可用作铝或铜焊接助熔剂、能腐蚀玻璃等。四氟硼酸铵中存在_______(填序号):
A 离子键 B σ键 C π键 D 范德华力 E 配位键
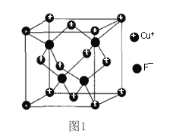
(4)CuCl的熔点为426℃,熔化时几乎不导电;CuF的熔点为908℃。
①CuF比CuCl熔点高的原因是_____________;
②CuF的晶胞结构如图1。F-填充在Cu+围成的_______空隙中,空隙填充率为________%。
Ⅱ.AA705合金(含Cu、Al、Zn、Mg和Ti)几乎与钢一样坚固,但重量仅为钢的三分之一,已被用于飞机机身和机翼、智能手机外壳上等。
(5)CN-、NH3、H2O和OH-等配体都能与Zn2+形成配离子。1mol [Zn(NH3)4]2+含________ molσ键,中心离子的配位数为__________。
钛晶体有两种品胞,如图所示。
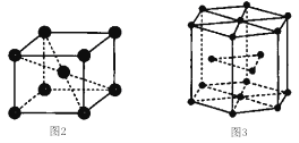
①如图2所示,晶胞的空间利用率为______(用含п的式子表示)。
②已知图3中六棱柱边长为x pm,高为y pm。该钛晶胞密度为D g·cm-3,NA为______mol-1(用含x y和D的式子表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】来自植物精油中的三种活性成分的结构简式如下。下列说法正确的是
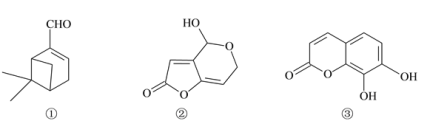
A.①中含有2个手性碳原子数
B.②难溶于水,分子中含有3种官能团
C.1 mol②、③与浓溴水反应,最多消耗2 mol Br2
D.1 mol③最多可与3 mol NaOH发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以玉米(主要成分是淀粉)为原料制备乙醇的流程如下:

下列说法中不正确的是
A. C12H22O11属于二糖B. 可采取分液的方法分离乙醇和水
C. 可用碘水检验淀粉是否完全水解D. 葡萄糖可以在酒曲酶作用下分解生成乙醇
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前,人们对环境保护、新能源开发非常重视。
(1)已知:①CH4(g)+2NO2(g)![]() N2(g)+CO2(g)+2H2O(g)ΔH1=-860.0kJmol1
N2(g)+CO2(g)+2H2O(g)ΔH1=-860.0kJmol1
②2NO2(g)![]() N2O4(g)ΔH2=-66.9kJmol1
N2O4(g)ΔH2=-66.9kJmol1
写出CH4催化还原N2O4(g)生成N2、H2O(g)和CO2的热化学方程式_____________。
(2)用活性炭还原法也可以处理氮氧化物,某研究小组向某密闭容器加入一定量的活性炭和NO,发生反应:C(s)+2NO(g)![]() N2(g)+CO2(g) ΔH,在t1℃时,反应进行到不同时间测得各物质的物质的量浓度如下:
N2(g)+CO2(g) ΔH,在t1℃时,反应进行到不同时间测得各物质的物质的量浓度如下:
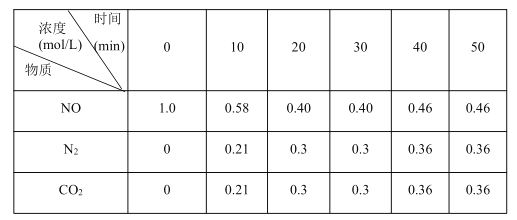
①根据表中数据分析,t1℃时,该反应在0~20min的平均反应速率v(NO)=_____________,该反应的平衡常数K=_____________。
②30min时,只改变某一条件,根据上表中的数据判断改变的条件可能是_____________(填字母代号)。
A.适当缩小容器的体积B.加入合适的催化剂
C.加入一定量的活性炭D.通入一定量的NO
③若30min后升高温度至t2℃,达到平衡时,容器中NO、N2、CO的浓度之比为5∶3∶3,则达到新平衡时NO的转化率_____________(填“升高”或“降低”);ΔH_____________0(填“>”或“<”)。
(3)①已知在一定温度下,反应2NH3(g)+CO2(g)![]() H2NCOONH4(s)ΔH=159.5kJmol1,在2L恒容密闭容器中充入2molNH3和1molCO2,到达平衡时放出127.6kJ的热量,此时,c(NH3)为_____________。
H2NCOONH4(s)ΔH=159.5kJmol1,在2L恒容密闭容器中充入2molNH3和1molCO2,到达平衡时放出127.6kJ的热量,此时,c(NH3)为_____________。
②有一种可充电电池NaAl/FeS,电池工作时Na+的物质的量保持不变,并且是用含Na+的导电固体作为电解质,已知该电池负极电极反应式为Nae=Na+,则正极反应式为____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com