
| 18g |
| 18g/mol |
| 35.2g |
| 44g/mol |


 提分百分百检测卷系列答案
提分百分百检测卷系列答案 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案 能考试全能100分系列答案
能考试全能100分系列答案科目:高中化学 来源: 题型:
| A、H+、Ba2+、HCO3-、Cl- |
| B、K+、Fe3+、I-、NO3- |
| C、NH4+、AlO2-、Cl-、OH- |
| D、K+、SO42-、S2-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、过量CO2通入澄清石灰水中:CO2+Ca2++2OH-=CaCO3↓+H2O |
| B、Na2O2与水发生反应:O22-+H2O=2OH-+H2↑ |
| C、向AlCl3溶液中加入过量的NaOH溶液:Al3++3OH-=Al(OH)3↓ |
| D、Ca(HCO3)2与足量的NaOH溶液反应:Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
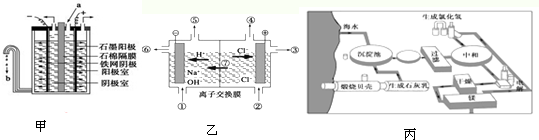
查看答案和解析>>
科目:高中化学 来源: 题型:
 已知A、J、D、E、G是元素周期表中1~36号元素,其原子序数依次增大.A与另外四种元素既不在同一周期,也不在同一主族.J和D同主族,E和G同周期;元素G是周期表中的第7列元素,E的最外层电子数与最内层电子数相同,E跟J可形成离子化合物,其晶胞结构(其中J原子在晶胞内部)如图.
已知A、J、D、E、G是元素周期表中1~36号元素,其原子序数依次增大.A与另外四种元素既不在同一周期,也不在同一主族.J和D同主族,E和G同周期;元素G是周期表中的第7列元素,E的最外层电子数与最内层电子数相同,E跟J可形成离子化合物,其晶胞结构(其中J原子在晶胞内部)如图.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、实验室制备乙烯时加入碎瓷片,可以防止暴沸 |
| B、用KMnO4滴定H2C2O4时需要用到两支酸式滴定管 |
| C、进行中和热的测定实验时,必须用到两个量筒和两个温度计 |
| D、实验室测定化学反应速率时,需要用到仪器秒表 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com