
 已知A、J、D、E、G是元素周期表中1~36号元素,其原子序数依次增大.A与另外四种元素既不在同一周期,也不在同一主族.J和D同主族,E和G同周期;元素G是周期表中的第7列元素,E的最外层电子数与最内层电子数相同,E跟J可形成离子化合物,其晶胞结构(其中J原子在晶胞内部)如图.
已知A、J、D、E、G是元素周期表中1~36号元素,其原子序数依次增大.A与另外四种元素既不在同一周期,也不在同一主族.J和D同主族,E和G同周期;元素G是周期表中的第7列元素,E的最外层电子数与最内层电子数相同,E跟J可形成离子化合物,其晶胞结构(其中J原子在晶胞内部)如图.| 1 |
| 8 |
| 1 |
| 2 |
| 1 |
| 8 |
| 1 |
| 2 |
| 5-1×3 |
| 2 |
| 1 |
| 8 |
| 1 |
| 2 |


 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案科目:高中化学 来源: 题型:
| A、2种 | B、3种 | C、4种 | D、5种 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 有三份不同质量的铁粉样品①②③,甲、乙、丙三位同学各取一份样品分别与含有0.8molHNO3的稀硝酸反应,反应后硝酸和铁均无剩余,且硝酸的还原产物只有NO.据此回答下列问题:
有三份不同质量的铁粉样品①②③,甲、乙、丙三位同学各取一份样品分别与含有0.8molHNO3的稀硝酸反应,反应后硝酸和铁均无剩余,且硝酸的还原产物只有NO.据此回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
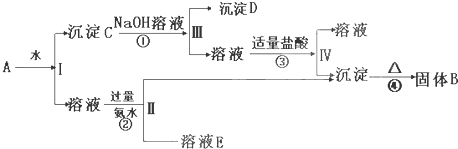
查看答案和解析>>
科目:高中化学 来源: 题型:
 ③白磷 ④氯气⑤
③白磷 ④氯气⑤ ⑥
⑥37 17 |
35 17 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 浓H2SO4 |
| △ |

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1 mol Cl2作为氧化剂得到的电子数为NA |
| B、标准状况下,22.4 L氢气和氧气的混合气体,所含分子数为NA |
| C、22.4 L的氮气中含有7NA个电子 |
| D、标准状况下,1 mol氦气含有的原子数为2NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com