
 “酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯.回答下列问题:
“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯.回答下列问题: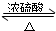 CH3COOC2H5+H2O,
CH3COOC2H5+H2O,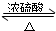 CH3COOC2H5+H2O;
CH3COOC2H5+H2O;

 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案科目:高中化学 来源: 题型:
| A、1.5mol/L |
| B、2.0mol/L |
| C、1.0mol/L |
| D、3.0mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

| 时间/浓度 | c(CO)(mol/L) | c(H2 )(mol/L) | c(CH3OH)(mol/L) |
| 起始 | 0.200 | 0.300 | 0.000 |
| 第4min | a | b | c |

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)把物质进行分类,是认识物质的组成、结构、性质和用途的便捷途径.请用分类的方法来认识以下物质(填序号):①NaCl晶体 ②金属铜 ③盐酸 ④SO2 ⑤蔗糖 ⑥BaSO4 ⑦纯醋酸
(1)把物质进行分类,是认识物质的组成、结构、性质和用途的便捷途径.请用分类的方法来认识以下物质(填序号):①NaCl晶体 ②金属铜 ③盐酸 ④SO2 ⑤蔗糖 ⑥BaSO4 ⑦纯醋酸查看答案和解析>>
科目:高中化学 来源: 题型:
| A、v(A)=0.3 mol/(L?min) |
| B、v(B)=0.6 mol/(L?min) |
| C、v(C)=0.5 mol/(L?min) |
| D、v(A)=0.1 mol/(L?s) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com