
【题目】用NA表示阿伏加德罗常数,下列说法正确的是( )
A.1mol OH﹣中含有9NA个电子
B.28g的CO气体中含有NA个氧原子
C.1L 1mol/L的AlCl3溶液中含有NA个Al3+
D.常温常压下11.2 L的甲烷气体含有的分子数为0.5NA
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】实验室用固体氯化钠配制0.5 L 0.2 mol·L-1的NaCl溶液,下列哪种仪器不是必须使用的( )
A. 500 mL容量瓶 B. 胶头滴管 C. 试管 D. 托盘天平
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】辉铜矿的主要成分是Cu2S,可用于制取金属铜和铜盐。
(1)己知部分反应的热化学方程式如下:
C(s)+S2(g)=CS2(g) ΔH1=akJ·mol-1
Cu2S(s)+H2(g)=2Cu(s)+H2S(g) ΔH2=bkJ·mol-1
2H2S(g)=2H2(g)+S2(g) ΔH3=ckJ·mol-1
则C(s)+2Cu2S(s)=4Cu(s)+CS2(g)的ΔH=_________kJ·mol-1(用含 a、b、c 的代数式表示)。
(2)从辉铜矿中浸取铜元素,可用FeCl3作浸取剂。
①反应Cu2S+4FeCl3=2CuCl2+4FeCl2+S,每生成1mol CuCl2,反应中转移电子的数目为_______;浸取时,在有氧环境下可维持Fe3+较高浓度。有关反应的离子方程式是______________。
②浸取过程中加入洗涤剂溶解硫时,铜元素的浸取率的变化见如图。其原因是_____________。


③353K时,向FeCl3浸取液中加入CuCl2,能加快铜元素的浸取速率,其反应原理可用化学方程式表示为:__________,CuCl+FeCl3=CuCl2+FeCl2。
(3)辉铜矿可由黄铜矿(主要成分为CuFeS2)通过电化学反应转变而成,有关转化见如图。转化时正极的电极反应式为_________________。
(4)CuCl悬浊液中加入Na2S,发生的反应为2CuCl(s)+S2-(aq) ![]() Cu2S(s)+2Cl-(aq),该反应的平衡常数K= ________[己知Ksp(CuCl)=1.2×l0-6,Ksp(Cu2S)=2.5×l0-43]。
Cu2S(s)+2Cl-(aq),该反应的平衡常数K= ________[己知Ksp(CuCl)=1.2×l0-6,Ksp(Cu2S)=2.5×l0-43]。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化碳的捕捉、封存与再利用是实现温室气体减排的重要途径之一。
(1)二氧化碳的电子式为___________。
(2)下列利用二氧化碳的反应中原子利用率达100%的是_________(填序号)。
a.CO2+2NH3 ![]() CO(NH2)2+H2O
CO(NH2)2+H2O
b.CO2+CH4![]() CH3COOH
CH3COOH
c.CO2+3H2![]() CH3OH+H2O
CH3OH+H2O
d.![]()
(3)一种正在开发的利用二氧化碳制取甲醇的流程如下:
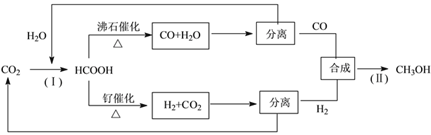
①反应(Ⅰ)将CO2和H2O转化为甲酸常用途径有两种,如下图(a)和(b)。
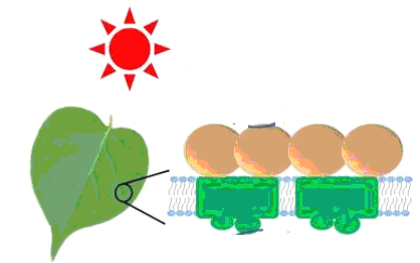
图(a)中能量主要转化方式为___________,图(b)中发生反应的化学方程式为___________。
②在5L的恒温恒容密闭容器中充入1moLCO和4molH2,加入催化剂发生反应,测得CO及CH3OH的物质的量随时间变化如下图所示。
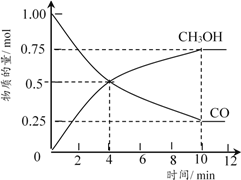
图中第___________min(填数字)反应达到平衡,CO在0~4min内的平均反应速率比在4~8min内的快,其原因是___________;达到平衡时氢气的浓度为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】3mol A和2.5 mol B混合于2L密闭容器中,发生的反应如下:3A(g)+B(g)![]() xC(g)+2D(g)5min后反应达到平衡,容器内压强变小,测得D的平均反应速率为0.1mol/(L·min),下列结论正确的是
xC(g)+2D(g)5min后反应达到平衡,容器内压强变小,测得D的平均反应速率为0.1mol/(L·min),下列结论正确的是
A. A的平均反应速率为0.1mol/(L·min)
B. 平衡时,B的转化率为20%
C. 平衡时,C的浓度为0.125 mol/L
D. 平衡时,容器内的压强为原来的0.875倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.砷(As)是第四周期VA族元素,可以形成As2O3、As2O5、H3AsO3、H3AsO4等化合物,有着广泛的用途。回答下列问题:
(1)画出砷的原子结构示意图______________。
(2)工业上常将含砷废渣(主要成分为As2S3)制成浆状,通入O2氧化,生成H3AsO4和单质硫。写出发生反应的化学方程式________________________________。
(3)298K时,将20mL3×mol·L-1Na3AsO3、20mL3×mol·L-1I2和20ml NaOH溶液混合,发生反应:![]() 。溶液中
。溶液中![]() 与反应时间(t)的关系如图所示。
与反应时间(t)的关系如图所示。
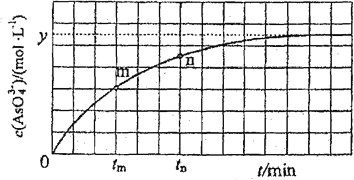
①下列可判断反应达到平衡的是________(填标号)。
a.溶液的pH不再变化
b.v(I-)=2v(![]() )
)
C.![]() /
/![]() 不再变化
不再变化
d.c(I-)=2ymol·L-1
②tm时,V正________V逆(填“大于”“小于”或“等于”)。
③tm时V逆________tm时V逆(填“大于”“小于”或“等于”),理由是____________________________。
Ⅱ.碳是重要的短周期元素,可以形成CO、CO2、CH3OH(甲醇)等化合物。
(1)以CO或CO2与H2为原料,在一定条件下均可合成甲醇,你认为用哪种合成设计线路更符合“绿色化学”理念:(用化学反应方程式表示)________。
(2)如图所示是用于合成甲醇产品中甲醇含量的检测仪。
写出该仪器工作时的总反应式及正极反应式:
总反应式__________________________
正极反应式__________________________
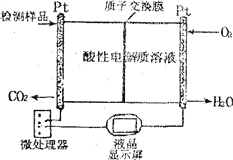
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W、R为五种短周期元素,其原子半径和最外层电子数之间的关系如下图所示。下列说法错误的是
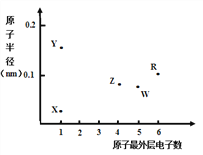
A. 简单离子半径:Y < W
B. 最高价氧化物对应水化物的酸性:Z < W
C. R为氧元素
D. X与Z可以形成正四面体结构的分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应C(s)+H2O(g)![]() CO(g)+H2(g)在一密闭容器中进行,则下列说法或结论中,能够成立的是( )
CO(g)+H2(g)在一密闭容器中进行,则下列说法或结论中,能够成立的是( )
A. 其他条件不变仅将容器的体积缩小一半,反应速率减小
B. 反应达平衡状态时:v正(CO)=v逆(H2O)
C. 保持体积不变,充入少量He使体系压强增大,反应速率一定增大
D. 其他条件不变,适当增加C(s)的质量会使反应速率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】448mL某气体在标准状况下的质量为1.28g,该气体的摩尔质量约为( )
A. 32g B. 64 C. 64g·mol-1 D. 32 g·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com