
【题目】设NA为阿伏加德罗常数的值,下列叙述正确的是( )
A.6g石墨烯(单层石墨)中含有六元环的个数为1NA
B.S2和S8的混合物共6.4g,其中所含硫原子数一定为0.2NA
C.将1molCl2通入水中,溶液中HClO、Cl-、ClO-粒子数之和为2NA
D.17g羟基(-OT)中含有的电子数为9NA
 口算能手系列答案
口算能手系列答案科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、M的原子序数依次增大,它们组成一种团簇分子,结构如图所示。X、M的族序数均等于周期序数,Y原子核外最外层电子数是其电子总数的![]() 。下列说法正确的是( )
。下列说法正确的是( )
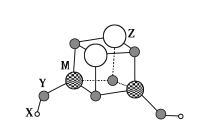
A.简单离子半径:Z>M>Y
B.常温下Z和M的单质均能溶于浓硝酸
C.X+与Y22-结合形成的化合物是离子晶体
D.Z的最高价氧化物的水化物是中强碱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在防治新冠肺炎的工作中,过氧乙酸(CH3COOOH)是众多消毒剂中的一种。过氧乙酸具有强氧化能力,可将各种病原微生物杀灭。其性质不稳定,遇热易分解。某同学利用高浓度的双氧水和冰醋酸制备少量过氧乙酸并进行相关实验。
I.过氧乙酸的制备.
向100mL的三颈烧瓶中加入25mL冰醋酸,滴加42.5%双氧水15mL,之后加入一定量浓硫酸,维持反应温度为40℃,磁力搅拌4h后,室温静置12h。
(1)三颈烧瓶中制取过氧乙酸的反应方程式为____。
(2)资料显示浓硫酸的用量对制得的过氧乙酸的质量分数有较为明显的影响,如图所示。根据图中数据分析本实验中浓硫酸的用量应为____(填字母)。
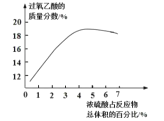
a 1.5mL-2.0mL b 3.5mL-4.0mL C 5.5mL-6.0mL
II.过氧乙酸质量分数的测定
准确称取1.00g过氧乙酸样液,定容子100mL容量瓶中,取其中10.00mL溶液调pH后,用KMnO4标准溶液滴定至溶液出现浅红色,以除去过氧乙酸试样中剩余的H2O2,再加入过量KI溶液,摇匀,用0.0200mol/LNa2S2O3标准溶液滴定至终点,消耗Na2S2O3标准溶液25.00mL。(已知:![]() )。
)。
(3)加入过量KI溶液前,需除去H2O2的原因是____(用离子方程式表示)。
(4)滴定时所选指示剂为____;制得过氧乙酸溶液中过氧乙酸质量分数为____%。
(5)过氧乙酸用于消毒时,要将原液稀释到0.2%-0.5%之间。若实验室配制1000mL过氧乙酸稀溶液时,除需使用烧杯和玻璃棒外,还要用到以下哪些仪器____(填标号)。
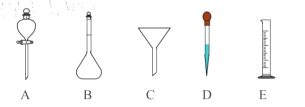
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物丙可由如图反应得到,则丙的结构不可能是
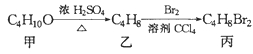
A. CH3CBr2CH2CH3B. (CH3)CBrCH2Br
C. CH3CH2CHBrCH2BrD. CH3(CHBr)2CH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,![]() 和
和![]() 的电离常数分别为
的电离常数分别为![]() 和
和![]() 。将
。将![]() 和体积均相同的两种酸溶液分别稀释,其
和体积均相同的两种酸溶液分别稀释,其![]() 随加水体积的变化如图所示。下列叙述正确的是( )
随加水体积的变化如图所示。下列叙述正确的是( )

A. 曲线Ⅰ代表![]() 溶液
溶液
B. 溶液中水的电离程度:b点>c点
C. 从c点到d点,溶液中 保持不变(其中
保持不变(其中![]() 、
、![]() 分别代表相应的酸和酸根离子)
分别代表相应的酸和酸根离子)
D. 相同体积a点的两溶液分别与![]() 恰好中和后,溶液中
恰好中和后,溶液中![]() 相同
相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定压强下,向10 L密闭容器中充入1 mol S2Cl2和1 mol Cl2,发生反应S2Cl2(g)+Cl2(g) ![]() 2SCl2(g)。Cl2与SCl2的消耗速率(v)与温度(T)的关系如图所示,以下说法中不正确的是( )
2SCl2(g)。Cl2与SCl2的消耗速率(v)与温度(T)的关系如图所示,以下说法中不正确的是( )
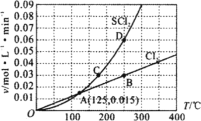
A.正反应的活化能大于逆反应的活化能
B.达到平衡后再加热,平衡向逆反应方向移动
C.A、B、C、D四点对应状态下,达到平衡状态的为B、D
D.一定温度下,在恒容密闭容器中,达到平衡后缩小容器体积,重新达到平衡后,Cl2的平衡转化率不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)84消毒液的有效成分是_____。
(2)O2F2为共价化合物,各原子均满足8电子稳定结构,写出O2F2的电子式_____。
(3)NaOH的碱性比Mg(OH)2强,主要原因是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂-硫电池具有高能量密度、续航能力强等特点。使用新型碳材料复合型硫电极的锂-硫电池工作原理示意图如图,下列说法正确的是
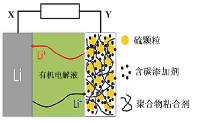
A.电池放电时,X电极发生还原反应
B.电池充电时,Y电极接电源正极
C.电池放电时,电子由锂电极经有机电解液介质流向硫电极
D.向电解液中添加Li2SO4水溶液,可增强导电性,改善性能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)聚四氟乙烯商品名称为“特氟龙”,可做不粘锅涂层。它是一种准晶体,该晶体是一种无平移周期序、但有严格准周期位置序的独特晶体。可通过___方法区分晶体、准晶体和非晶体。
(2)下列氮原子的电子排布图表示的状态中,能量由低到高的顺序是___(填字母代号)。
A.![]() B.
B.![]()
C.![]() D.
D.![]()
(3)某种铀氮化物的晶体结构是NaCl型。NaCl的Bom-Haber循环如图所示。已知:元素的一个气态原子获得电子成为气态阴离子时所放出的能量称为电子亲和能。下列有关说法正确的是__(填标号)。
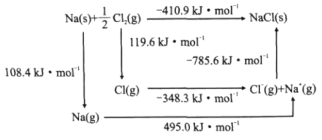
a.Cl-Cl键的键能为119.6kJ/mol b.Na的第一电离能为603.4kJ/mol
c.NaCl的晶格能为785.6kJ/mol d.Cl的第一电子亲和能为348.3kJ/mol
(4)配合物[Cu(En)2]SO4的名称是硫酸二乙二胺合铜(Ⅱ),是铜的一种重要化合物。其中En 是乙二胺(H2N-CH2-CH2-NH2)的简写。
①该配合物中含有化学键有___(填字母编号)。
A.离子键 B.极性共价键 C.非极性共价键 D.配位键 E.金属键
②配体乙二胺分子中氮原子、碳原子轨道的杂化类型分别为___、___。
③乙二胺和三甲胺[N(CH3)3]均属于胺,且相对分子质量相近,但乙二胺比三甲胺的沸点高得多,原因是___。
④乙二胺(H2NCH2CH2NH2)是一种有机化合物,乙二胺能与Mg2+、Cu2+等金属离子形成稳定环状离子,其原因是___,其中与乙二胺形成的化合物稳定性相对较高的是___(填“Mg2+”或“Cu2+”)。
⑤与氨气互为等电子体的阳离子为___,与S位于同一周期,且第一电离能小于S的非金属元素符号为___。
(5)①金属钛的原子堆积方式如图1所示,则金属钛晶胞俯视图为____。

A. B.
B. C.
C. D.
D.
②某砷镍合金的晶胞如图所示,设阿伏加德罗常数的值为NA,该晶体的密度ρ=__g·cm-3。
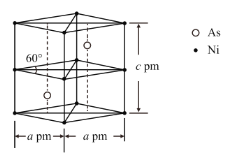
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com