
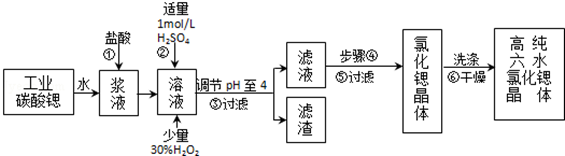
将5.60 g铁投入100 mL某浓度的盐酸中,铁和盐酸恰好完全反应。
求:(1)5.6 0 g铁的物质的量
0 g铁的物质的量
(2)所用盐酸中HCl中的物质的量浓度
(3)反应中生成的H2在标准状况下的体积
科目:高中化学 来源: 题型:解答题
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 |
| 开始沉淀的pH | 1.5 | 6.5 |
| 沉淀完全的pH | 3.7 | 9.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 选项 | 规律 | 结论 |
| A | 沸点高的物质制备沸点低的物质 | 钙置换出铷,或浓磷酸制备HI |
| B | 反应物浓度越大,反应速率越快 | 常温下,相同的铝片中分别加入足量的浓、稀硝酸,浓硝酸中铝片先溶解完 |
| C | 结构和组成相似的物质,沸点随相对分子质量增大而升高 | BCl3沸点低于AlCl3,CO2沸点低于SiO2 |
| D | 溶解度小的沉淀易向溶解度更小的沉淀转化 | AgCl沉淀中滴加NaI溶液,会得到AgI沉淀 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年天津市高二上9月调研化学试卷(解析版) 题型:选择题
已知乙醇、石墨和氢气的燃烧热分别为a、b、c(均为正值,单位均为kJ·mol-1)。则反应2C(s,石墨)+2H2(g)+H2O(l)==C2H5OH(l)的焓变为( )
A.(a-2b-2c) kJ·mol-1
B.(2b+2c-a) kJ·mol-1
C.(b+c-a) kJ·mol-1
D.(a-2b-c) kJ·mol-1
查看答案和解析>>
科目:高中化学 来源:2016-2017学年天津市高二上9月调研化学试卷(解析版) 题型:选择题
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示。下列叙述正确的是( )
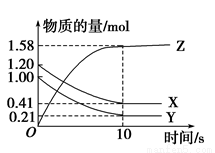
A.反应开始到10 s末时,用Z表示的反应速率为0.158 mol·L-1·s-1
B.反应开始到10 s末时,X的物质的量浓度减少了0.79 mol·L-1
C.反应开始到10 s时,Y的转化率为79.0%
D.反应的化学方程式为X(g)+Y(g) Z(g)
Z(g)
查看答案和解析>>
科目:高中化学 来源:2016-2017学年陕西省高一上第一次月考化学卷(解析版) 题型:选择题
将50 mL 0.1 mol·L-1的NaCl溶液和50 mL 0.5 mol·L-1的CaCl2溶液混合后,若溶液的体积为二者体积之和,则混合溶液中c(Cl-)为
A.2 mol·L-1 B.1 mol·L-1
C.0.67 mol·L-1  D.0.55 mol·L-1
D.0.55 mol·L-1
查看答案和解析>>
科目:高中化学 来源:2016-2017学年陕西省高一上第一次月考化学卷(解析版) 题型:选择题
90%的硫酸与10%的硫酸等体积混合,所得溶液的质量分数为
A.等于50% B.大于50% C.小于50% D.无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.05mol•L-1的H2SO4 | B. | 0.1mol•L-1的KNO3 | ||
| C. | 0.1mol•L-1的KOH | D. | 0.1mol•L-1的NH4NO3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com