
 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
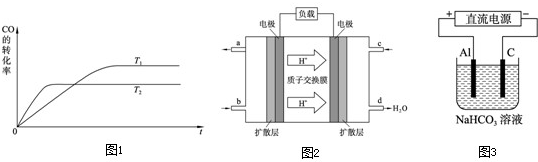
查看答案和解析>>
科目:高中化学 来源: 题型:
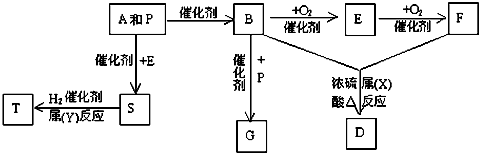
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、电极X是正极,其电极反应为Cu-2e-=Cu2+ |
| B、银电极质量逐渐减小,Y溶液中c(Ag+)增大 |
| C、当X电极质量减少0.64g时,电解质溶液中有0.02mol电子转移 |
| D、外电路中电流计的指针有偏转 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、羟基和氢氧根离子两种粒子所含电子数相等 | ||
| B、1mol乙烯与Cl2完全加成,然后与Cl2发生取代反应,共消耗氯气4mol | ||
C、某烃的结构简式为: ,在同一平面上的碳原子数为6个 ,在同一平面上的碳原子数为6个 | ||
D、乙醛溶液与足量的银氨溶液共热的离子方程式为:CH3CHO+2[Ag(NH3)2]++2OH-
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com