
【题目】将E和F加入密闭容器中,在一定条件下发生反应:E(g)+F(s)![]() 2G(g)。忽略固体体积,平衡时G的体积分数(%)随温度和压强的变化如下表所示。下列说法错误的是
2G(g)。忽略固体体积,平衡时G的体积分数(%)随温度和压强的变化如下表所示。下列说法错误的是
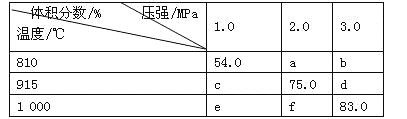
A.a<54.0
B.b> f
C.915 ℃,2.0 MPa时E的转化率为60%
D.K(1000 ℃)>K(810 ℃)
【答案】B
【解析】
A.由于该反应的正反应是气体体积增大的反应,在其它条件不变时,增大压强,平衡向气体体积减小的方向移动,所以达到平衡时,G的体积分数减小,因此a<54.0,A正确;
B.由于压强b>a,所以平衡时G的体积分数b<a,温度810℃<915℃,在压强不变时,升高温度G的体积分数增大,说明该反应的正反应是吸热反应,由于温度f是1000℃>915℃,所以平衡时G的体积分数f大于75.0,因此b<f,B错误;
C.915 ℃,2.0 MPa时G的体积分数是75.0%,则未反应的E是25.0%,假设反应开始时E的物质的量是amol,反应消耗E是x,则反应产生的F是2x,所以(a-x)/2x=25.0%÷75.0%,解得x=0.6a,所以E的转化率为60%,C正确;
D.根据B分析可知该反应的正反应是吸热反应,升高温度,平衡向吸热的正反应方向移动,所以K(1000 ℃)>K(810 ℃),D正确;
答案选B。


科目:高中化学 来源: 题型:
【题目】(1)反应mA+nB![]() pC在某温度下达到平衡。
pC在某温度下达到平衡。
①若A、B、C都是气体,加压后正反应速率小于逆反应速率,则m、n、p的关系___。
②若A、B、C都是气体,且m+ n>p,而加压或升温平衡移动方向相同,则△H___0。
(2)一定条件下,将2molSO2和1molO2充入容积为2L的密闭容器中发生反应:2SO2(g)+O2(g)![]() 2SO3(g),2分钟后反应达平衡,此时SO2的浓度为0.2mol/L,完成:
2SO3(g),2分钟后反应达平衡,此时SO2的浓度为0.2mol/L,完成:
①SO2的转化率为___。
②用O2表示的化学反应速率为__。
③平衡常数为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在10L容器中进行如下反应:A(g)+B(g)![]() 2C(g),2分钟后,B由2mol减少到1.2mol,则用单位内A的浓度变化表示的反应速率(VA)是 ( )
2C(g),2分钟后,B由2mol减少到1.2mol,则用单位内A的浓度变化表示的反应速率(VA)是 ( )
A.0.02mol/(L·min)B.0.04mol/(L·min)
C.0.08mol/(L·min)D.0.8mol/(L·min)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】支撑海港码头基础的钢管柱,常用外加电流的阴极保护法进行防腐,工作原理如图所示,其中高硅铸铁为惰性辅助阳极。下列有关表述不正确的是

A. 通入保护电流使钢管桩表面腐蚀电流接近于零
B. 通电后外电路电子被强制从高硅铸铁流向钢管桩
C. 高硅铸铁的作用是作为损耗阳极材料和传递电流
D. 通入的保护电流应该根据环境条件变化进行调整
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用生物燃料电池原理研究室温下氨的合成,电池工作时MV2+/MV+在电极与酶之间传递电子,示意图如下所示。下列说法错误的是

A. 相比现有工业合成氨,该方法条件温和,同时还可提供电能
B. 阴极区,在氢化酶作用下发生反应H2+2MV2+![]() 2H++2MV+
2H++2MV+
C. 正极区,固氮酶为催化剂,N2发生还原反应生成NH3
D. 电池工作时质子通过交换膜由负极区向正极区移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环戊二烯(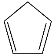 )是重要的有机化工原料,广泛用于农药、橡胶、塑料等生产。回答下列问题:
)是重要的有机化工原料,广泛用于农药、橡胶、塑料等生产。回答下列问题:
环戊二烯可用于制备二茂铁(Fe(C5H5)2,结构简式为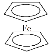 ),后者广泛应用于航天、化工等领域中。二茂铁的电化学制备原理如下图所示,其中电解液为溶解有溴化钠(电解质)和环戊二烯的DMF溶液(DMF为惰性有机溶剂)。
),后者广泛应用于航天、化工等领域中。二茂铁的电化学制备原理如下图所示,其中电解液为溶解有溴化钠(电解质)和环戊二烯的DMF溶液(DMF为惰性有机溶剂)。
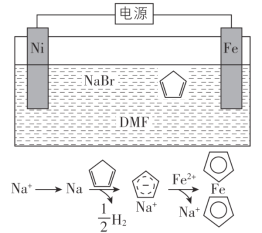
该电解池的阳极为____________,总反应为__________________。电解制备需要在无水条件下进行,原因为_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示的装置,C、D、E、F、X、Y都是惰性电极。将电源接通后,向(乙)中滴入酚酞溶液,在F极附近显红色。则下列说法正确的是( )

A.电源B极是正极
B.(甲)(乙)装置的C、D、E、F电极均有单质生成,其物质的量之比为1∶2∶2∶1
C.欲用(丙)装置给铜镀银,H应该是Ag,电镀液是AgNO3溶液
D.装置(丁)中Y极附近红褐色变深,说明氢氧化铁胶粒带正电荷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应C2H6(g)![]() C2H4(g)+H2(g) △H>0,在一定条件下于密闭容器中达到平衡。下列各项措施中,不能提高乙烷平衡转化率的是( )
C2H4(g)+H2(g) △H>0,在一定条件下于密闭容器中达到平衡。下列各项措施中,不能提高乙烷平衡转化率的是( )
A. 增大容器容积B. 升高反应温度
C. 分离出部分氢气D. 等容下通入惰性气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室需要配制0.50 mol/LNaCl溶液480 mL。按下列操作步骤填上适当的文字,以使整个操作完整。
(1)选择仪器。完成本实验所必需的仪器有:托盘天平(精确到0.1 g)、药匙、烧杯、玻璃棒、________、________以及等质量的两片滤纸。
(2)计算称量。配制该溶液需称取NaCl晶体________g。
(3)溶解、冷却,该步实验中需要使用玻璃棒,目的是___________。
(4)转移、洗涤。
(5)向容量瓶中加入蒸馏水,直到液面离刻度线约1-2厘米时,改用___________滴加蒸馏水至液面与刻度线相切。盖好瓶塞,摇匀。如果加水时液面超过刻度线,将使配得的溶液浓度___________(填“偏高”、“偏低”或“无影响”)。
(6)将配好的溶液静置一段时间后,倒入指定的试剂瓶,并贴好标签,注明配制的时间、溶液名称及浓度。
(7)在配制过程中,某学生观察定容时液面情况如图所示,所配溶液的浓度会________(填“偏高”、“偏低”或“无影响”)。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com