
【题目】氯化铁是常见的水处理剂,工业上制备无水FeCl3的一种工艺如图: 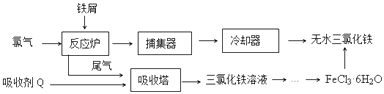
(1)由FeCl36H2O晶体制备无水FeCl3应采取的措施是: .
(2)六水合氯化铁在水中的溶解度如下:
温度/℃ | 0 | 10 | 20 | 30 | 50 | 80 | 100 |
溶解度(g/100gH2O) | 74.4 | 81.9 | 91.8 | 106.8 | 315.1 | 525.8 | 535.7 |
从FeCl3溶液制得FeCl36H2O晶体的操作步骤是:加入少量盐酸、、、过滤、洗涤、干燥.
(3)常温下,若溶液的pH控制不当会使Fe3+沉淀,pH=4时,溶液中c(Fe3+)=molL﹣1 . (常温下Ksp[Fe(OH)3]=2.6×10﹣39)
(4)FeCl3的质量分数通常可用碘量法测定:称取2.300g无水氯化铁样品,溶于稀盐酸,再转移到100mL容量瓶,用蒸馏水定容;取出10.00mL,加入稍过量的KI溶液,充分反应后,滴入某一指示剂并用0.1000molL﹣1Na2S2O3溶液滴定用去12.50mL.
已知:I2+2S2O32﹣=2I﹣+S4O62﹣
①写出加入稍过量的KI溶液反应的离子方程式.
②求样品中氯化铁的质量分数(写出计算过程)
【答案】
(1)在通HCl气体的氛围下加热
(2)加热浓缩;冷却结晶
(3)2.6×10﹣9
(4)解:①KI溶液与FeCl3发生氧化还原反应生成碘单质和二价铁,离子方程式为:2Fe3++2I﹣=2Fe2++I2;
②12.50mLNa2S2O3溶液含有Na2S2O3物质的量为12.50×10﹣3 L×0.1000molL﹣1=1.25×10﹣3mol,则:
根据关系式:
2Fe3+ | ~ | I2 | ~ | 2S2O32﹣ |
2 | 2 | |||
n(Fe3+) | 1.25×10﹣3mol×10 |
所以 n(Fe3+)=1.25×10﹣3mol×10=1.25×10﹣2mol,
所以2.300g无水氯化铁样品中氯化铁的质量为1.25×10﹣2mol×162.5g/mol=2.03125g
所以2.300g无水氯化铁样品中氯化铁的质量分数为 ![]() ×100%=88.32%;
×100%=88.32%;
故答案为:88.32%.
【解析】解:(1)因为Fe3+易水解生成挥发性的HCl,所以由FeCl36H2O晶体得到无水FeCl3 , 应在氯化氢气流中加热FeCl36H2O晶体,得到无水FeCl3 ,
所以答案是:在通HCl气体的氛围下加热;(2)由表中数据可知,温度越高氯化铁的溶解度越高,由溶液获得晶体需加加热浓缩,再冷却结晶;所以答案是:加热浓缩;冷却结晶;(3)当溶液pH为4时,溶液中c(OH﹣)=10﹣10mol/L,Ksp[Fe(OH)3]=c(Fe3+)c3(OH﹣)=2.6×10﹣39 , 所以溶液中c(Fe3+)= ![]() =2.6×10﹣9 molL﹣1 , 所以答案是:2.6×10﹣9;
=2.6×10﹣9 molL﹣1 , 所以答案是:2.6×10﹣9;


 名校联盟快乐课堂系列答案
名校联盟快乐课堂系列答案科目:高中化学 来源: 题型:
【题目】下列反应既是氧化还原反应,又是放热反应的是( )
A.铝与稀盐酸的反应
B.Ba(OH)28H2O与NH4Cl的反应
C.灼热的碳与二氧化碳的反应
D.NaOH与HCl的反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知四氯化碳是一种无色有毒易挥发液体,不溶于水,密度>1 g/cm3,沸点约为76.8℃。要从水与四氯化碳的混合物里将四氯化碳分离出来,下列方法中最合理的是
A. 过滤 B. 分液 C. 蒸馏 D. 萃取
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应A(g)+3B(g)2C(g)+2D(g)在4种不同情况下反应速率分别如下,其中反应速率v最大的是( )
A.v(A)=9.0mol/(Lmin)
B.v(B)=0.6 mol/(Ls)
C.v(C)=0.3 mol/(Ls)
D.v(D)=0.1 mol/(Ls)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中进行X2(g)+Y2(g)![]() 2Z(g)的反应,已知起始时其中X2、Y2、Z各物质浓度分别为0.1molL﹣1、0.3molL﹣1、0.2molL﹣1 , 反应达到平衡时,各物质浓度可能是( )
2Z(g)的反应,已知起始时其中X2、Y2、Z各物质浓度分别为0.1molL﹣1、0.3molL﹣1、0.2molL﹣1 , 反应达到平衡时,各物质浓度可能是( )
A.c(X)=0.2molL﹣1
B.c(Y2)=0.35molL﹣1
C.c(Y2)=0.2molL﹣1
D.c(Z)=0.4molL﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质用途的说法中,不正确的是
A. HNO3可以制化肥、农药 B. NH3作制冷剂
C. Fe3O4用作红色油漆和涂料 D. Na2O2用作供氧剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用环己醇脱水的方法合成环己烯,该实验的装置如下图所示:
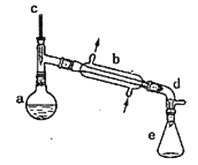
可能用到的有关数据如下:
相对分子质量 | 密度/(g·cm-3) | 沸点/℃ | 溶解性 | |
环已醇 | 100 | 0.9618 | 161 | 微溶于水 |
环已烯 | 82 | 0.8102 | 83 | 难溶于水 |
按下列实验步骤回答问题:
Ⅰ.产物合成
在a中加入10.0g环己醇和2片碎瓷片,冷却搅拌下慢慢加入1mL浓硫酸,b中通入冷却水后,开始缓慢加热a,控制馏出物的温度接近90℃。
(l)碎瓷片的作用是________;b的名称是________;
(2)a中发生主要反应的化学方程式为____________________________;本实验最容易产生的有机副产物的结构简式为________。
Ⅱ.分离提纯
将反应粗产物倒入分液漏斗中,依次用少量5%碳酸钠溶液和水洗涤,分离后加人无水氯化钙颗粒,静置一段时间后弃去氯化钙,最终通过操作X得到纯净的环己烯,称量,其质量为4.1g。
(3)用碳酸钠溶液洗涤的作用是________,操作X的名称为________。
Ⅲ.产物分析及产率计算
(4)①核磁共振氢谱可以帮助鉴定产物是否为环己烯,环己烯分子中有_______种不同化学环境的氢原子。
② 本实验所得环己烯的产率是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制H2的化学反应是Zn + H2SO4 = ZnSO4 + H2↑。该反应中,氧化剂是_________,被氧化的物质是_________。若反应生成1 mol H2, 则反应中电子转移的物质的量为_________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是( )
A.将氯气通入水中:Cl2+H2O═2H++Cl﹣+ClO﹣
B.碳酸钙溶于醋酸:CaCO3+2H+═Ca2++CO2↑+H2O
C.铁与FeCl3溶液反应:Fe+Fe3+═2Fe2+
D.硫酸溶液与氯化钡溶液混合:Ba2++SO ![]() ═BaSO4↓
═BaSO4↓
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com