
【题目】下列离子方程式正确的是( )
A.将氯气通入水中:Cl2+H2O═2H++Cl﹣+ClO﹣
B.碳酸钙溶于醋酸:CaCO3+2H+═Ca2++CO2↑+H2O
C.铁与FeCl3溶液反应:Fe+Fe3+═2Fe2+
D.硫酸溶液与氯化钡溶液混合:Ba2++SO ![]() ═BaSO4↓
═BaSO4↓
科目:高中化学 来源: 题型:
【题目】氯化铁是常见的水处理剂,工业上制备无水FeCl3的一种工艺如图: 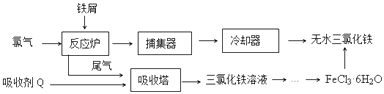
(1)由FeCl36H2O晶体制备无水FeCl3应采取的措施是: .
(2)六水合氯化铁在水中的溶解度如下:
温度/℃ | 0 | 10 | 20 | 30 | 50 | 80 | 100 |
溶解度(g/100gH2O) | 74.4 | 81.9 | 91.8 | 106.8 | 315.1 | 525.8 | 535.7 |
从FeCl3溶液制得FeCl36H2O晶体的操作步骤是:加入少量盐酸、、、过滤、洗涤、干燥.
(3)常温下,若溶液的pH控制不当会使Fe3+沉淀,pH=4时,溶液中c(Fe3+)=molL﹣1 . (常温下Ksp[Fe(OH)3]=2.6×10﹣39)
(4)FeCl3的质量分数通常可用碘量法测定:称取2.300g无水氯化铁样品,溶于稀盐酸,再转移到100mL容量瓶,用蒸馏水定容;取出10.00mL,加入稍过量的KI溶液,充分反应后,滴入某一指示剂并用0.1000molL﹣1Na2S2O3溶液滴定用去12.50mL.
已知:I2+2S2O32﹣=2I﹣+S4O62﹣
①写出加入稍过量的KI溶液反应的离子方程式.
②求样品中氯化铁的质量分数(写出计算过程)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在给定的条件下,下列选项所示的物质间转化均能实现的是( )
A.NH3 ![]() NO
NO ![]() NaNO2
NaNO2
B.Fe2O3 ![]() Fe
Fe ![]() FeCl3
FeCl3
C.SiO2 ![]() H2SiO3(aq)
H2SiO3(aq) ![]() Na2SiO3
Na2SiO3
D.CuCl2(aq) ![]() Cu(OH)2
Cu(OH)2 ![]() Cu2O
Cu2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2016年诺贝尔化学奖由法国、美国及荷兰的三位化学家分获,以表彰他们在“分子马达”研究方面的成就,一种光驱分子马达结构如图所示.有关该分子的说法正确的是( ) 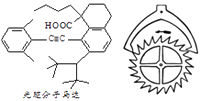
A.该分子中有两个手性碳原子
B.两个苯环可以处于同一平面
C.能与NaHCO3和酸性KMnO4溶液反应
D.1mol该分子最多可与2molH2发生加成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨工艺的一个重要工序是铜洗,其目的是用铜液[醋酸二氨合铜(I)、氨水]吸收在生产过程中产生的CO和CO2等气体。铜液吸收CO的反应是放热反应,其反应方程式为:Cu(NH3)2Ac+CO+NH3![]() [Cu(NH3)3CO]Ac
[Cu(NH3)3CO]Ac
完成下列填空:
(1)如果要提高上述反应的反应速率,可以采取的措施是_________。(选填编号)
a.减压b.增加NH3的浓度 c.升温 d.及时移走产物
(2)铜液中的氨可吸收二氧化碳,写出该反应的化学方程式。_____________________
(3)简述铜液吸收CO及铜液再生的操作步骤(注明吸收和再生的条件)__________________。
(4)铜液的组成元素中,短周期元素原子半径从大到小的排列顺序为___________。其中氮元素原子最外层电子排布的轨道表达式是_____________。通过比较_____________可判断氮、磷两种非金属元素的非金属性强弱。
(5)已知CS2与CO2分子结构相似,CS2的电子式是_______。醋酸二氨合铜中铜的配位数为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸钴(CoOC2O3)用途广泛,一种利用水钴矿[主要成分为Co2O3,还含少量Fe2O3、Al2O3、MgO、MnO、CaO等]制取CoC2O4·2H2O的工艺流程如下:
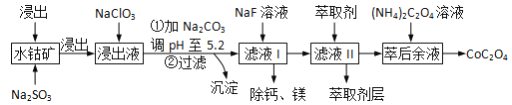
已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
完全沉淀的pH | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(1)浸出过程中加入Na2SO3的作用是将__________还原(填离子符号),该步反应的离子方程式为_________。
(2)NaClO3的作用是将浸出液中的Fe2+氧化成Fe3+ ,氯元素被还原为最低价。该反应的离子方程式为_______________。
(3)加Na2CO3能使浸出液中Fe3+、Al3+转化成氢氧化物沉淀的原因是(用离子方程式表示,写出其中一个即可)_____________。
(4)萃取剂对金属离子的萃取率与pH的关系如右图所示。使用萃取剂适宜的pH=________(填序号)左右。
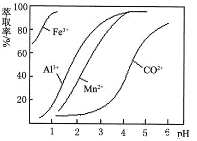
A.2.0 B.3.0 C.4.0
(5)滤液I“除钙,镁”是将溶液中Ca2+与Mg2+转化为MgF2、CaF2沉淀。已知Ksp(MgF2)=7.35×10-11、Ksp(CaF2)=1.05×10-10,当加入过量NaF后,所得滤液c(Mg2+)/c(Ca2+)=_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯乙烯是无色有毒,带有辛辣气味的易燃液体,结构如右图所示。人体吸入过多的苯乙烯蒸气时会引起中毒,在空气中的允许浓度在1×10-4 kgm-3以下。下列关于苯乙烯的性质推断中正确的是( )

A. 它的分子式是C8H8
B. 它能使溴的四氯化碳溶液褪色,不能使酸性高锰酸钾溶液褪色
C. 它易溶于水,也易溶于有机溶剂
D. 苯乙烯中所有的原子不可能共平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,杠杆AB两端分别挂有体积相同、质量相等的空心铜球和空心铁球,调节杠杆并使其在水中保持平衡,然后小心地向烧杯中央滴入浓CuSO4溶液,一段时间后,下列有关杠杆的偏向判断正确的是(实验过程中,不考虑铁丝反应及两球的浮力变化)( ) 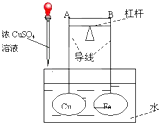
A.杠杆为导体和绝缘体时,均为A端高,B端低
B.杠杆为导体和绝缘体时,均为A端低,B端高
C.当杠杆为绝缘体时,A端低,B端高;为导体时,A端高,B端低
D.当杠杆为绝缘体时,A端高,B端低;为导体时,A端低,B端高
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com