
【题目】草酸钴(CoOC2O3)用途广泛,一种利用水钴矿[主要成分为Co2O3,还含少量Fe2O3、Al2O3、MgO、MnO、CaO等]制取CoC2O4·2H2O的工艺流程如下:
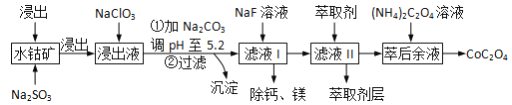
已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
完全沉淀的pH | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(1)浸出过程中加入Na2SO3的作用是将__________还原(填离子符号),该步反应的离子方程式为_________。
(2)NaClO3的作用是将浸出液中的Fe2+氧化成Fe3+ ,氯元素被还原为最低价。该反应的离子方程式为_______________。
(3)加Na2CO3能使浸出液中Fe3+、Al3+转化成氢氧化物沉淀的原因是(用离子方程式表示,写出其中一个即可)_____________。
(4)萃取剂对金属离子的萃取率与pH的关系如右图所示。使用萃取剂适宜的pH=________(填序号)左右。
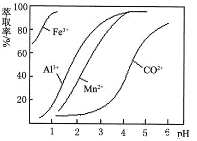
A.2.0 B.3.0 C.4.0
(5)滤液I“除钙,镁”是将溶液中Ca2+与Mg2+转化为MgF2、CaF2沉淀。已知Ksp(MgF2)=7.35×10-11、Ksp(CaF2)=1.05×10-10,当加入过量NaF后,所得滤液c(Mg2+)/c(Ca2+)=_____。
【答案】 Fe3+、Co3+ SO32-+2Fe3++H2O=SO42-+2Fe2++2H+或SO32-+2Co3++H2O=SO42-+2Co2++2H+ ClO3-+6Fe2++6H+=6Fe3++Cl-+3H2O 2Al3++3CO32-+3H2O=2Al(OH)3↓+3CO2↑或2Fe3++3CO32-+3H2O=2Fe(OH)3↓+3CO2↑ B 0.7
【解析】含钴废料中加入盐酸和亚硫酸钠,可得CoCl2、AlCl3、FeCl2、MgCl2、CaCl2、MnCl2,加入NaClO3,可得到FeCl3,然后加入Na2CO3调pH至5.2,可得到Fe(OH)3、Al(OH)3沉淀,过滤后所得滤液主要含有CoCl2、MgCl2、CaCl2、MnCl2,向溶液中加入NaF溶液,除去钙镁离子,然后过滤得到的滤液中II中加入萃取剂,萃取后溶液加入草酸铵,得到草酸钴。
(1)亚硫酸钠具有还原性,能还原氧化性离子Fe3+、Co3+,所以浸出过程中加入Na2SO3的目的是将Fe3+、Co3+还原,反应的离子方程式为SO32-+2Fe3++H2O=SO42-+2Fe2++2H+或SO32-+2Co3++H2O=SO42-+2Co2++2H+,故答案为:Fe3+、Co3+;SO32-+2Fe3++H2O=SO42-+2Fe2++2H+或SO32-+2Co3++H2O=SO42-+2Co2++2H+;
(2)NaClO3具有氧化性,能将浸出液中的Fe2+氧化成Fe3+,自身被还原生成氯离子,同时生成水,离子反应方程式为ClO3-+6Fe2++6H+=6Fe3++Cl-+3H2O,故答案为:ClO3-+6Fe2++6H+=6Fe3++Cl-+3H2O;
(3)Fe3+、Al3+水解导致溶液呈酸性,碳酸根离子和氢离子反应,从而促进水解平衡向右移动,产生氢氧化铁、氢氧化铝沉淀,2Al3++3CO32-+3H2O=2Al(OH)3↓+3CO2↑或2Fe3++3CO32-+3H2O=2Fe(OH)3↓+3CO2↑,故答案为:2Al3++3CO32-+3H2O=2Al(OH)3↓+3CO2↑或2Fe3++3CO32-+3H2O=2Fe(OH)3↓+3CO2↑;
(4)根据流程图可知,此时溶液中存在Mn2+、Co2+金属离子;由萃取剂对金属离子的萃取率与pH的关系可知,调节溶液pH在3.0~3.5之间,可使Mn2+完全沉淀,并防止Co2+转化为Co(OH)2沉淀,故答案为:B;
(5)当加入过量NaF后,所得滤液 =
=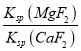 =
=![]() =0.7,故答案为:0.7。
=0.7,故答案为:0.7。


 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案科目:高中化学 来源: 题型:
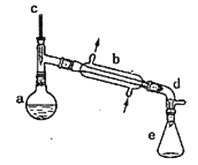
【题目】实验室用环己醇脱水的方法合成环己烯,该实验的装置如下图所示:
可能用到的有关数据如下:
相对分子质量 | 密度/(g·cm-3) | 沸点/℃ | 溶解性 | |
环已醇 | 100 | 0.9618 | 161 | 微溶于水 |
环已烯 | 82 | 0.8102 | 83 | 难溶于水 |
按下列实验步骤回答问题:
Ⅰ.产物合成
在a中加入10.0g环己醇和2片碎瓷片,冷却搅拌下慢慢加入1mL浓硫酸,b中通入冷却水后,开始缓慢加热a,控制馏出物的温度接近90℃。
(l)碎瓷片的作用是________;b的名称是________;
(2)a中发生主要反应的化学方程式为____________________________;本实验最容易产生的有机副产物的结构简式为________。
Ⅱ.分离提纯
将反应粗产物倒入分液漏斗中,依次用少量5%碳酸钠溶液和水洗涤,分离后加人无水氯化钙颗粒,静置一段时间后弃去氯化钙,最终通过操作X得到纯净的环己烯,称量,其质量为4.1g。
(3)用碳酸钠溶液洗涤的作用是________,操作X的名称为________。
Ⅲ.产物分析及产率计算
(4)①核磁共振氢谱可以帮助鉴定产物是否为环己烯,环己烯分子中有_______种不同化学环境的氢原子。
② 本实验所得环己烯的产率是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图甲所示,纯电动公交车逐渐成为杭州街头常见的身影,磷酸铁锂电池是杭州市纯电动公交车所用的电池,现要从废旧磷酸铁锂电池中回收Fe、Al、Li等物质,采用图乙所示方法.已知:磷酸铁锂电池溶解在H2SO4中含有Fe3+、Al3+、Li+、SO ![]() 、PO
、PO ![]() 等离子及少量不溶物,滤液c中含有大量Li+离子,Li2CO3可溶于冷水,不溶于热水.下列说法不正确的是( )
等离子及少量不溶物,滤液c中含有大量Li+离子,Li2CO3可溶于冷水,不溶于热水.下列说法不正确的是( ) 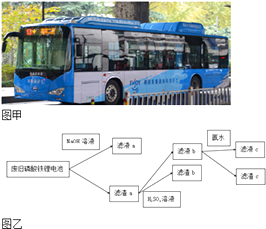
A.向滤液a中加入适量H2SO4溶液,可以得到白色沉淀
B.滤液b中加入氨水的目的是使Fe3+沉淀,滤渣c为红褐色
C.要将Li从溶液中析出,可在滤液c中加入足量Na2CO3溶液,加热浓缩,冷却结晶
D.图中的氨水可以用适量NaOH溶液代替
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是( )
A.将氯气通入水中:Cl2+H2O═2H++Cl﹣+ClO﹣
B.碳酸钙溶于醋酸:CaCO3+2H+═Ca2++CO2↑+H2O
C.铁与FeCl3溶液反应:Fe+Fe3+═2Fe2+
D.硫酸溶液与氯化钡溶液混合:Ba2++SO ![]() ═BaSO4↓
═BaSO4↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】PbO2及2PbCO3Pb(OH)2(碱式碳酸铅)均是生产铅酸蓄电池正极的原料.
(1)PbO2可由NaClO氧化Pb(NO3)2溶液得到.
①Pb(NO3)2被氧化为PbO2的离子方程式为 .
②Pb(NO3)2溶液中通入H2S发生Pb2+(aq)+H2S(aq)PbS(s)+2H+(aq),直至平衡,该反应的平衡常数为K=1已知:Ksp(PbS)=3.55×10﹣28;H2S电离常数Ka1=1.3×10﹣7 , Ka2=7.1×10﹣15].
(2)制备碱式碳酸铅的实验步骤如图1: 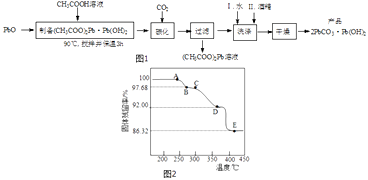
①“碳化”时,发生反应的化学方程式为 .
②“洗涤”时,经水洗涤后再用酒精洗涤的目的是 .
(3)为确定2PbCO3Pb(OH)2(相对式量:775)的热分解过程,进行如下实验:称取一定量(2)实验制得的样品放在热重分析仪中,在氩气流中热分解,测得样品的固体残留率(固体样品的剩余质量/固体样品的起始质量×100%)随温度的变化如图2所示.
①A→B过程中,从体系中逸出的分解产物(化合物)为(填化学式);C→D过程中,从体系中逸出的分解产物(化合物)为(填化学式).
②根据图中实验数据,计算并确定E点残留固体的化学式(写出计算过程).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于物质用途的说法错误的是
A. 液氨可用作制冷剂B. 二氧化硫可作食物和干果的防腐剂
C. Fe3O4可用作红色涂料D. 碳酸氢钠可用作面粉发酵
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据化学常识判断下列说法正确的是( )
A. 铅笔芯是主要含有铅的笔芯 B. 加碘食盐是加有I2的食盐
C. 碘酒是含有的I2的酒精 D. 纯碱是纯净的烧碱
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com