
����Ŀ����ͼ����ʾ�����綯��������Ϊ���ݽ�ͷ��������Ӱ��������﮵���Ǻ����д��綯���������õĵ�أ���Ҫ�ӷϾ�������﮵���л���Fe��Al��Li�����ʣ�����ͼ����ʾ��������֪��������﮵���ܽ���H2SO4�к���Fe3+��Al3+��Li+��SO ![]() ��PO
��PO ![]() �����Ӽ������������Һc�к��д���Li+���ӣ�Li2CO3��������ˮ����������ˮ������˵������ȷ���ǣ� ��
�����Ӽ������������Һc�к��д���Li+���ӣ�Li2CO3��������ˮ����������ˮ������˵������ȷ���ǣ� �� 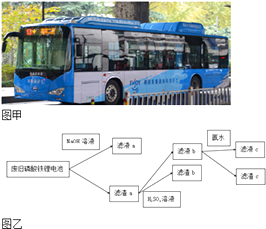
A.����Һa�м�������H2SO4��Һ�����Եõ���ɫ����
B.��Һb�м��백ˮ��Ŀ����ʹFe3+����������cΪ���ɫ
C.Ҫ��Li����Һ��������������Һc�м�������Na2CO3��Һ������Ũ������ȴ�ᾧ
D.ͼ�еİ�ˮ����������NaOH��Һ����
���𰸡�C
���������⣺A����Һa�к���ƫ�����ƣ�����������H2SO4��Һ������������������������������Һa�м�������H2SO4��Һ�����Եõ���ɫ��������A��ȷ��B����Һb�������������Լ��백ˮ�������ֽⷴӦ����������������������cΪ���ɫ������������B��ȷ��
C��Li2CO3��������ˮ����������ˮ�����Բ�����ȴ��Ӧ�����ȹ��˵ķ������룬��C����
D�����������������������ƣ�����ˮ����������NaOH��Һ���棬��D��ȷ��
��ѡC��
A����Һa�к���ƫ�����ƣ�����������H2SO4��Һ����������������������
B����Һb�������������Լ��백ˮ�������ֽⷴӦ��������������
C��Li2CO3��������ˮ����������ˮ�����Բ�����ȴ��Ӧ�����ȹ��˵ķ������룻
D�����������������������ƣ�����ˮ����������NaOH��Һ���森



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼΪ��Ӧ2H2��g��+O2��g���T2H2O��g���������仯ʾ��ͼ������˵����ȷ���ǣ� ��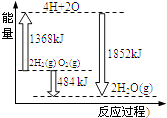
A.�÷�Ӧ�����ȷ�Ӧ����
B.��2molH2��1molO2���4molH��2molOԭ����Ҫ�ų�����
C.2molH2��g����1molO2��g����Ӧ����2molH2O��g�������ų�484kJ����
D.4molH��2molO����2molH2O��g�������ų�484kJ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪���� A��Ħ������Ϊ28g/mol���й�A��ת����ϵ��ͼ��ʾ����ش��������⣺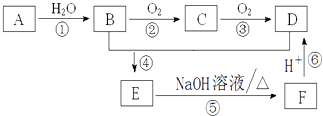
��1��C���������ŵ����ƣ� �� �ٵķ�Ӧ����Ϊ�� ��
��2��E�Ľṹ��ʽΪ�� ��
��3��B��C�Ļ�ѧ����ʽΪ�� ��
��4��E��F�Ļ�ѧ����ʽΪ�� �� ��Ӧ����Ϊ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ڸ����������£�����ѡ����ʾ�����ʼ�ת������ʵ�ֵ��ǣ� ��
A.NH3 ![]() NO
NO ![]() NaNO2
NaNO2
B.Fe2O3 ![]() Fe
Fe ![]() FeCl3
FeCl3
C.SiO2 ![]() H2SiO3��aq��
H2SiO3��aq�� ![]() Na2SiO3
Na2SiO3
D.CuCl2��aq�� ![]() Cu��OH��2
Cu��OH��2 ![]() Cu2O
Cu2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ڲ�ͬ�¶��£�ˮ�ﵽ����ƽ��ʱc(H+)��c(OH-)�Ĺ�ϵ��ͼ��ʾ������˵������ȷ����
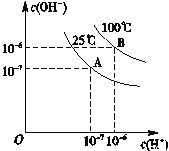
A. 25��ʱ��0.2mol/LBa(OH)2��Һ��0.2mol/LHCl��Һ�������ϣ�������Һ��pH����7
B. 25��ʱ��pH��12�İ�ˮ��pH��2��H2SO4��Һ�������ϣ�������Һ��pH����7
C. 100��ʱ��pH��12��NaOH��Һ��pH��2��H2SO4��Һ��������ʱǡ���кͣ�������Һ��pH����7
D. 100��ʱ��0.2mol/LNaOH��Һ��0.1mol/LH2SO4�������Ϻ�ǡ���кͣ�������ҺpH����7
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��2016��ŵ������ѧ���ɷ�������������������λ��ѧ�ҷֻ��Ա��������ڡ���������о�����ijɾͣ�һ�ֹ�����������ṹ��ͼ��ʾ���йظ÷��ӵ�˵����ȷ���ǣ� �� 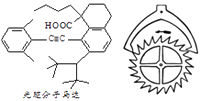
A.�÷���������������̼ԭ��
B.�����������Դ���ͬһƽ��
C.����NaHCO3������KMnO4��Һ��Ӧ
D.1mol�÷���������2molH2�����ӳ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ϳɰ����յ�һ����Ҫ������ͭϴ����Ŀ������ͭҺ[���������ͭ��I������ˮ]���������������в�����CO��CO2�����塣ͭҺ����CO�ķ�Ӧ�Ƿ��ȷ�Ӧ���䷴Ӧ����ʽΪ��Cu(NH3)2Ac��CO��NH3![]() [Cu(NH3)3CO]Ac
[Cu(NH3)3CO]Ac
���������գ�
��1�����Ҫ���������Ӧ�ķ�Ӧ���ʣ����Բ�ȡ�Ĵ�ʩ��_________����ѡ���ţ�
a.��ѹb.����NH3��Ũ�� c.���� d.��ʱ���߲���
��2��ͭҺ�еİ������ն�����̼��д���÷�Ӧ�Ļ�ѧ����ʽ��_____________________
��3������ͭҺ����CO��ͭҺ�����IJ������裨ע�����պ�������������__________________��
��4��ͭҺ�����Ԫ���У�������Ԫ��ԭ�Ӱ뾶�Ӵ�С������˳��Ϊ___________�����е�Ԫ��ԭ�����������Ų��Ĺ������ʽ��_____________��ͨ���Ƚ�_____________���жϵ��������ַǽ���Ԫ�صķǽ�����ǿ����
��5����֪CS2��CO2���ӽṹ���ƣ�CS2�ĵ���ʽ��_______�����������ͭ��ͭ����λ��Ϊ______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������(CoOC2O3)��;�㷺��һ������ˮ�ܿ�[��Ҫ�ɷ�ΪCo2O3����������Fe2O3��Al2O3��MgO��MnO��CaO��]��ȡCoC2O4��2H2O�Ĺ����������£�
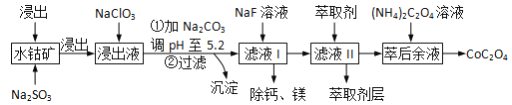
��֪���ٽ���Һ���е���������Ҫ��H+��Co2+��Fe2+��Mn2+��Al3+�ȣ�
�ڲ���������������������ʽ����ʱ��Һ��pH���±���
������ | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
��ȫ������pH | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
��1�����������м���Na2SO3�������ǽ�__________��ԭ�������ӷ��ţ����ò���Ӧ�����ӷ���ʽΪ_________��
��2��NaClO3�������ǽ�����Һ�е�Fe2+������Fe3+ ����Ԫ�ر���ԭΪ��ͼۡ��÷�Ӧ�����ӷ���ʽΪ_______________��
��3����Na2CO3��ʹ����Һ��Fe3+��Al3+ת�����������������ԭ���ǣ������ӷ���ʽ��ʾ��д������һ�����ɣ�_____________��
��4����ȡ���Խ������ӵ���ȡ����pH�Ĺ�ϵ����ͼ��ʾ��ʹ����ȡ�����˵�pH=________������ţ����ҡ�
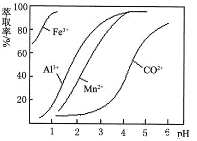
A��2.0 B��3.0 C��4.0
��5����ҺI�����ƣ�þ���ǽ���Һ��Ca2+��Mg2+ת��ΪMgF2��CaF2��������֪Ksp(MgF2)=7.35��10-11��Ksp(CaF2)=1.05��10-10�����������NaF��������Һc(Mg2+)/c(Ca2+)=_____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����л�������÷�Һ��������� ( )
A. �Ҵ������� B. �����屽
C. ����������Na2CO3��Һ D. �廯�غ͵������ˮ��Һ
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com