
| 编号 | 实验操作 | 预期现象和结论 | ||
| 步骤① | 取少量待测液于试管A中,D滴加2mol?L-1HCl至溶液呈酸性,加入几滴 |
证明待测液中含SO
| ||
| 步骤② | 有白色沉淀生成证明待测液中含SO
| |||
| 步骤③ | 另取少量待测液于试管C中,加入足量氯水,再加入四氯化碳,震荡,静置后观察颜色 | 待测液中含Br- |
| 编号 | 实验操作 | 预期现象和结论 |
| 步骤① | 新制饱和溴水 | 溴水褪色 |
| 步骤② | 另取少量待测液于试管B中,加入过量的2mol/L盐酸,再滴加适量1mol/LBaCl2溶液 | |
| 步骤③ | 溶液分层,下层液体呈橙红色 |


科目:高中化学 来源: 题型:阅读理解
| 编号 | 实验操作 | 预期现象和结论 |
| 步骤① | 取少量待测液加入试管中,加入过量的2 mol?L-1盐酸,再滴加适量l mol?L-1BaCl2溶液. 取少量待测液加入试管中,加入过量的2 mol?L-1盐酸,再滴加适量l mol?L-1BaCl2溶液. |
有白色沉淀生成,证明待测液中含SO42-. |
| 步骤② | 方法1:取出步骤①中适量上层清液于试管中,加入适量氯水,观察溶液的颜色.(若再加入四氯化碳,振荡,静置后观察颜色也可) 方法2:另取少量待测液加入试管中,加入足量的2 mol?L-1盐酸直到不产生气泡为止,再加入少量氯水,观察溶液的颜色.(若再加入四氯化碳,振荡,静置后观察颜色也可) 方法1:取出步骤①中适量上层清液于试管中,加入适量氯水,观察溶液的颜色.(若再加入四氯化碳,振荡,静置后观察颜色也可) 方法2:另取少量待测液加入试管中,加入足量的2 mol?L-1盐酸直到不产生气泡为止,再加入少量氯水,观察溶液的颜色.(若再加入四氯化碳,振荡,静置后观察颜色也可) |
溶液呈橙黄色,证明待测液中含Br-.(下层液体呈橙红色,证明待测液中含Br-.) 溶液呈橙黄色,证明待测液中含Br-.(下层液体呈橙红色,证明待测液中含Br-.) |
| … |
查看答案和解析>>
科目:高中化学 来源: 题型:
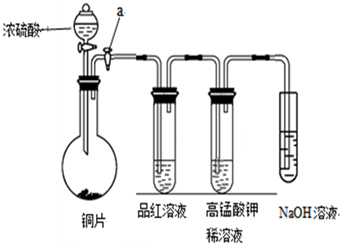
| 编号 | 实验操作 | 预期现象和结论 |
| 步骤① | 有白色沉淀生成,证明待测液中含SO42-. | |
| 步骤② | ||
| 步骤③ | ||
| … |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:2012届广东省中山市高三上学期期末考试化学试卷 题型:填空题
(13分).Ⅰ、研究性学习小组进行SO2的制备及性质探究实验,装置如下图(a为活塞,加热及固定装置已略去)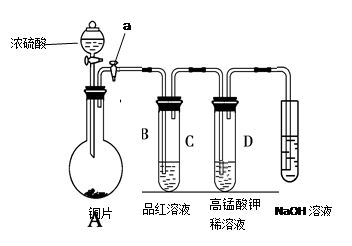
①连接仪器、 、加药品后,打开a,然后滴入浓硫酸,加热。
②铜与浓硫酸反应的化学方程式是:
。
③从品红溶液中观察到的现象说明SO2具有 性。
④高锰酸钾溶液中的实验现象是 。
Ⅱ、上述实验中NaOH溶液用于吸收剩余的SO2生成Na2SO3,Na2SO3是抗氧剂。向烧碱和Na2SO3混合溶液中加入少许溴水,振荡后溶液变为无色。
(1)写出在碱性中Br2氧化Na2SO3的离子方程式
(2)反应后的溶液含有SO32-、SO42-、Br-、OH-等阴离子,请填写鉴定其中SO42-和Br-的实验报告(步骤可增减)。
限选试剂:2 mol·L-1 HCl;1 mol·L-1 H2SO4;l mol·L-1 BaCl2;l mol·L-1 Ba(NO3)2;
0.1 mol·L-1 AgNO3;CCl4;新制饱和氯水。
| 编号 | 实验操作 | 预期现象和结论 |
| 步骤① | | 有白色沉淀生成,证明待测液中含SO42-。 |
| 步骤② | | |
| 步骤③ | | |
| …… | | |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com