
| A、点燃这种液体,然后观察火焰的颜色 |
| B、先加足量酸性高锰酸钾溶液,然后再加入溴水 |
| C、加入浓硫酸与浓硝酸后加热 |
| D、先加足量溴水,然后再加入酸性高锰酸钾溶液 |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| A、用氯气消毒浴池 |
| B、用稀盐酸除去热水瓶胆壁上的水垢(主要成分是CaCO3) |
| C、用食盐腌渍食物 |
| D、用小苏打治疗胃酸过多 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 溶解 |
| ① |
| BaCl2 |
| ② |
| NaOH |
| ③ |
| ④ |
| 过滤 |
| ⑤ |
| 适量盐酸 |
| ⑥ |
| 蒸发、结晶 |
| 干燥 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在食品中加入适量胡萝卜素以改善食品的外观 |
| B、用甲醛溶液保鲜水产品 |
| C、在酱油中加铁、粮食制品中加赖氨酸 |
| D、用蔗糖做食品的甜味剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、甲苯通过硝化反应生成三硝基甲苯 |
| B、甲苯能使酸性高锰酸钾溶液褪色 |
| C、甲苯燃烧产生很浓的黑烟 |
| D、1 mol甲苯与3 mol氢气发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
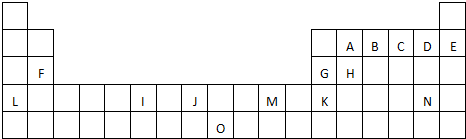
 A、B、C都是元素周期表中的短周期非金属元素,它们的核电荷数依次增大.A原子的核外成对电子数是未成对电子数的2倍,B原子的最外层p轨道的电子为半满结构,C是地壳中含量最多的元素.D、E是第四周期元素,D原子核外最外层电子数有1个电子,其余各层电子均充满;E原子核外未成对电子数在同周期中最多.请用对应的元素符号或化学式填空:
A、B、C都是元素周期表中的短周期非金属元素,它们的核电荷数依次增大.A原子的核外成对电子数是未成对电子数的2倍,B原子的最外层p轨道的电子为半满结构,C是地壳中含量最多的元素.D、E是第四周期元素,D原子核外最外层电子数有1个电子,其余各层电子均充满;E原子核外未成对电子数在同周期中最多.请用对应的元素符号或化学式填空:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com