
����Ŀ�����в��ֶ�����Ԫ�ص����ʻ�ԭ�ӽṹ���±���

��1������Ԫ��ԭ�Ӱ뾶�ɴ�С��˳���ǣ�дԪ�ط��ţ�_________________________��
��2��Ԫ��Y����Ԫ���γɵ�һ������YH4+��д�������ĵ���ʽ________(��Ԫ�ط��ű�ʾ)��
��3��TԪ�صļ������ӵĽṹʾ��ͼ��______________________��
��4��֤�������ӵĻ�ԭ�Ա�Z-ǿ�����ӷ���ʽ��____________________.
��5��Ԫ��Z�ĵ���������������Һ��Ӧ�Ļ�ѧ����ʽΪ_______________________ ��
��6����9g����X������������ȼ�գ���������ͨ��1L 1mol��L-1NaOH��Һ�У���ȫ���պ���Һ�ڼ�ѹ�������������ɣ��õ������ᾧˮ�Ĺ�������Ϊ____________g��
���𰸡���1��S Cl C N (2��)��
��2��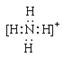 ��1�֣���
��1�֣���
��3�� ��1�֣���
��1�֣���
��4��C12+ S2-=2Cl-+S����2�֣���
��5��Cl2+ 2NaOH="NaCl+" NaClO +H2O (2��)��
��6��68.5g��2�֣���
�����������������������Ԫ��X�����������Ǵ�����2������X��CԪ�أ�Y��������˫ԭ�ӷ��ӣ��⻯���ˮ��Һ�Լ��ԣ���Y��NԪ�أ�T�����������ǵ��Ӳ�����2������T��SԪ�أ�ZԪ������ϼ���+7�ۣ���Z��ClԪ�ء�
��1��ԭ�Ӻ�����Ӳ���Խ�࣬ԭ�Ӱ뾶Խ��ԭ�Ӻ�����Ӳ�����ͬʱ��ԭ������ԽС��ԭ�Ӱ뾶Խ����������Ԫ��ԭ�Ӱ뾶�ɴ�С��˳����S�� Cl ��C ��N��
��2��NH4+����ʽ��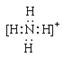 ��
��
��3��TԪ����S����������ӵĽṹʾ��ͼ��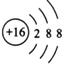 ��
��
��4��Ԫ�صķǽ�����Խǿ����������ӵĻ�ԭ�Ծ�Խ����Ԫ�صķǽ�����Cl��S�����Ի�ԭ��Cl-��S2-��֤���ķ�Ӧ��C12+ S2-=2Cl-+S����
��5��Ԫ��Z�ĵ���Cl2������NaOH��Һ������Ӧ������NaCl��NaClO��ˮ������������������Һ��Ӧ�Ļ�ѧ����ʽΪCl2+ 2NaOH="NaCl+" NaClO +H2O��
��6��9gC�����ʵ�����n(C)=9g��12g/mol=0.75mol������CԪ���غ��֪�������CO2�����ʵ�����0��75mol��1L 1mol��L-1NaOH��Һ���е����ʵ����ʵ�����n(NaOH)=c��V=1mol/L��1L=1mol����CO2ͨ�뵽NaOH��Һ��������Ӧ����̼���ơ�̼�����ƣ�����C�غ��֪n(Na2CO3)+n(NaHCO3��=0.75mol������NaԪ���غ�ɵ�2n(Na2CO3)+n(NaHCO3��=1mol�����n(Na2CO3)=0.25mol��n(NaHCO3��=0.5mol����ȫ���պ���Һ�ڼ�ѹ�������������ɣ��õ������ᾧˮ�Ĺ�������Ϊm=0.25mol��106g/mol+0.5mol��84g/mol=26.5g+42g=68.5g��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ȤС����ʵ�����ü����Ҵ���ŨH2SO4���廯�ƺ�����ˮ�Ļ�������Ʊ������飬�����鷴Ӧ�IJ��ָ������̽������������ʡ���֪��NaBr+H2SO4![]() NaHSO4+HBr��
NaHSO4+HBr��
��һ����������Ʊ�������ļ��飺�������ͼװ�ã����мг�������������������ˮ��û�л����������ʵ�鲽�裬�ش��������⣺

��1���Ʊ������У�����������ˮ����Ŀ���� ������ĸ����
a�����ٸ�����ϩ���ѵ�����
b������Br2������
c������HBr�Ļӷ�
d��ˮ�Ƿ�Ӧ�Ĵ���
��2�����鸱�������Ƿ����廯�⣺Ϩ��ƾ��ƣ�����ֱ�������Ϸ��������ӡ���a���������ȼ�����Ӧֱ����ȴ��ͨ��B��Cװ�ü��顣B��C��Ӧʢ�ŵ��Լ��ֱ��� �� ������ĸ����
a���� b��ˮ c��NaOH ��Һ d����������Һ
��3������ȥ�������е���������Br2����ȷ������ ������ĸ����
a��KI��Һϴ��
b������������Һϴ��
c�������Ȼ�̼��ȡ
d��������������Һϴ��
���������������ʵ�̽����ijͬѧ����ͼװ�ã�����̨���ƾ��Ƶ�δ��������̽������������ʡ����Թ��м���10 mL 6molL-1NaOHˮ��Һ��5 mL �����飬ˮԡ���ȡ����۲쵽___________ ����ʱ��������������NaOHˮ��Һ����ȫ��Ӧ���÷�Ӧ�Ļ�ѧ����ʽΪ ��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����һ����ȷ����( )
A��Na2O2�������������������ӵĸ�����Ϊ1��1
B�����Լ�ƿ��ȡ�������µ�δʹ�õ��ƿɷŻ�ԭ�Լ�ƿ��
C����NaͶ�뱥��Na2CO3��Һ��,�ᵼ����Һ��������
D������Naʧ��,����CO2���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ȷ���ǣ� ��
A. ��Ũ���ᱣ������ɫ����ƿ�� B. �����ƺͼر�����ú����
C. Na2CO3���Ա����ڲ������IJ���ƿ�� D. NaOH���������ֽ�ϳ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����15�֣�ʵ������ȡ�����������װ������ͼ��ʾ�������������������գ�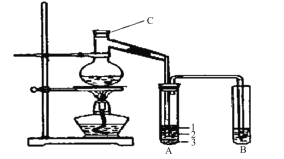
��1��װ��ͼ��C����������Ϊ ����C�м���ķ�Ӧ�����廯�ơ� ��1:1�����ᡣ���������1��1���������õĶ�������Ϊ ��ѡ���ţ���
a����ƽ b����Ͳ c������ƿ d���ζ���
��2��д������ʱ��ƿ�з�������Ҫ��Ӧ�Ļ�ѧ����ʽ ��
��3���������ﵼ��ʢ�б�ˮ�������Թ�A�У���ˮ������������ ����ͼ��ʾ�Թ�A�е����ʷ�Ϊ���㣬�����ڵ� �㡣
��4���Թ�A�г��˲����ˮ֮�⣬�����ܴ��� �� (д����ѧʽ)��
��5����Ũ���������ʵ�飬���Թ�A�л�õ��л�����Ⱥ�ɫ����ȥ�������ʵ�������ķ����� ��ѡ���ţ���
a������
b������������Һϴ��
c�������Ȼ�̼��ȡ
d��������������Һϴ��
���Թ�B�е����Ը��������Һ��ɫ��ʹ֮��ɫ�����ʵ�����Ӧ���� ��
��6��ʵ��Ա��ʦ���������װ���е��������Ӳ��ֶ��ijɱ������ӿڣ���ԭ���ǣ� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������(��ѧʽΪ:Na2S2O5)����ɫ��ĩ��ˮ��Һ�����ԣ��ܳ��ֽ⣬��ǿ����ų�һ�ִ̼�����ζ�����塣����һ�ֻ���ԭ�ϣ�����������������
��ҵ�ϣ�����ʪ���������������ƣ�ʪ�����������������У�
��һ�����ڱ���̼������Һ��ͨ��������SO2������PH=4.1�������������ƣ�
�ڶ���������
������������
�����������ݣ��ش����⣺
��1��������������S�Ļ��ϼ�Ϊ
��2����һ����ѧ����ʽΪ��
��3�����������ƺ����ⶨ��ȡ������������ƷԼ0.15g �����ܷ�ƿ�У�����0.05mol/L��(I2)�ζ�Һ50ml����������ҡ�ܽ������1ml����0.1mol/L��������ƣ�Na2S2O3���ζ�Һ�ζ��������յ�ʱ���ӵ���ָʾҺ2ml�������ζ�����ɫ��ʧ����ȥ�����������ҺVmL�������ζ�������пհԱȡ�
��֪��ÿ1ml��ζ�Һ��0.05mol/L���൱��4.750mg��Na2S2O5��
�÷�Ӧ���������ӷ���ʽ���ֱ�Ϊ��
a�� 3H2O + S2O52- + 2I2 = 2SO42- + 4I- + 6H+
b: 5H2O + S2O32- + 4I2 = 2SO42- + 8I- + 10H+
��a��Ӧ��ÿ����1mol��ԭ��ת�� mol���ӣ�
�ڵζ����յ�ʱ���ж������ǣ� ��
�۽��������Ƶ���������Ϊ����ʽ��ʾ�������������� �������õ�����Է���������Na2S2O5=190��
�����ڵⵥ����ˮ���ܽ�ȵͣ���˵�ζ�Һͨ����I2��KI���ܵõ��⣨KI3���ζ�Һ��ȡ12.7g�ⵥ�ʺ�26.6g�⻯�ؼ�ˮ50mL�ܽ������3�Σ�������1000mL���õ�(KI3���ζ�Һ���ʵ���Ũ��Ϊ ���õ�(KI3���ζ�Һ�뽹�������Ʒ�Ӧʱ���� �ԣ����������ԭ������[�����õ������ԭ��������I=127��K=39]
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������һ����Ҫ�Ļ�����Ʒ��2SO2+O2![]() 2SO3�����������е���Ҫ��Ӧ�����ж��ڸ÷�Ӧ��˵������ȷ������ ��
2SO3�����������е���Ҫ��Ӧ�����ж��ڸ÷�Ӧ��˵������ȷ������ ��
A��ֻҪѡ�����˵�������SO2��O2����ȫ��ת��ΪSO3
B���÷�Ӧ�ﵽƽ���Ӧ����ȫֹͣ�ˣ������淴Ӧ���ʾ�Ϊ��
C�������Ӧǰ������18Oԭ����ɵ�O2����Ӧ�ﵽƽ��״̬ʱ�� 18O�����������ж�����
D���ڹ�ҵ�ϳ�SO3ʱ��Ҫͬʱ���Ƿ�Ӧ���ʺͷ�Ӧ�ܴﵽ���������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ij��������ɫ����Һ�����ܺ������������е������֣�
Na����NH4����Cl����Mg2����Ba2����CO32����SO42������ȡ���ݸ�100mL��Һ��������ʵ�飺
����һ�ݼ�������AgNO3��Һ�г���������������ϡ�������������ܽ⣻
���ڶ��ݼ�����NaOH��Һ��ּ��Ⱥ��ռ�������0.896L(��״��)��
�������ݼ�����BaCl2��Һ���˺��ָ���õ�����6.27g���پ�����ϡ����ϴ�ӡ��������������Ϊ2.33g����������ʵ��������й����ݣ��ش��������⣺
��1��ԭ��Һ��һ�����ڵ��������� ��һ�������ڵ������� �����ܴ��ڵ������� ��
��2�����з�����ѧ��Ӧ�����ӷ���ʽΪ ��
��3���������ɿ�����ϡ����ij�����ѧʽΪ �����ʵ���Ϊ mol,�ó�������ϡ��������ӷ���ʽΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��[��ѧ����ѡ��3�����ʽṹ������]
Ԫ��A��B��C��D��E��F��G��Ԫ�����ڱ��е�λ������ͼ��ʾ���ش��������⣺

��1��G�Ļ�̬ԭ�Ӻ�������Ų�ʽΪ________��ԭ�ӵĵ�һ�����ܣ�D________E���>����<������
��2�����ݼ۲���ӻ������ۣ��۲���Ӷ�֮��ij�����С������˳��l��l > l��b > b��b��lΪ�¶Ե��Ӷԣ�bΪ���ϵ��Ӷԣ��������A2C�е�A��C��A���ǿɵó��Ľ�����________��
A��180�� B���ӽ�120������С��120��
C���ӽ�120����������120�� D���ӽ�109��28������С��109��28��
��3��������G(BC)5���۵�Ϊ��20�棬�е�Ϊ103�棬���������________���壬�������д��ڵĻ�ѧ��������________�����ڿ�����ȼ�����ɺ���ɫ�������Ӧ�Ļ�ѧ����ʽΪ________��
��4��������BCF2�����幹��Ϊ________������Bԭ�ӵ��ӻ����������________��д��������BCF2������ͬ�ռ乹�͵ĺ����������________��
��5��������EC�ľ����ṹ��ͼ��ʾ����������a=0.424nm��ÿ�������к���___________��E2������ʽ����EC������ܶȣ�g��cm-3��______________��

�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com