【答案】
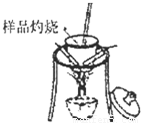
分析:方案一:该方案原理为在加热的条件下Na
2CO
3能够稳定存在,而NaHCO
3较易发生如下的分解反应2NaHCO
3=Na
2CO
3+CO
2↑+H
2O,从而根据残留的固体的量推算出样品中碳酸钠的质量分数.该方案根据加热后残渣的质量来求解,要加热至恒重,以保证NaHCO
3全部分解.
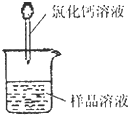
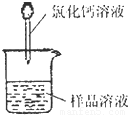
方案二:该方案原理为在样品中加入CaCl
2溶液,其中Na
2CO
3可与CaCl
2发生反应Na
2CO
3+CaCl
2=CaCO
3↓+2NaCl,而NaHCO
3与CaCl
2则不反应.从而根据产生的沉淀量,得出纯碱的质量分数.
方案关键是测定CaCO
3沉淀的质量,自然要保证沉淀完全,要正确过滤好.
(1)沉淀会附着氯化钠、氯化钙.
(2)根据碳酸钙计算碳酸钠质量,再根据质量分数定义计算碳酸钠质量分数.
(3)在一定量样品中加入足量Ca(OH)
2溶液,此时分别发生如下反应Na
2CO
3+Ca(OH)
2=CaCO
3↓+2NaOH,
NaHCO
3+Ca(OH)
2=CaCO
3↓+NaOH+H
2O,均产生CaCO
3沉淀,根据样品的总量和生成CaCO
3沉淀的量,就可得出纯碱的质量分数.
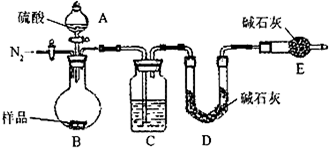
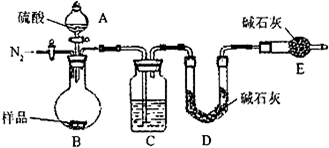
方案三:该方案原理为一定量混合样品与足量的稀硫酸分别发生如下反应Na
2CO
3+H
2SO
4=Na
2SO
4+CO
2↑+H
2O,
2 NaHCO
3+H
2SO
4=Na
2SO
4+2CO
2↑+2H
2O↑,根据所产生的CO
2的质量,可以分别求得样品中Na
2CO
3和NaHCO
3的质量从而得出纯碱的质量分数.该方案关键是要获得产生的CO
2的质量,在实验前要检查装置的气密性,要将装置中的CO
2全部被碱石灰所吸收,要称量碱石灰在吸收CO
2前后的质量.
(1)C装置干燥二氧化碳.
(2)实验前容器内含有空气,空气中含有二氧化碳,会影响生成的二氧化碳的量,反应后装置中容器内含有二氧化碳,不能被C中碱石灰完全吸收,导致测定结果有较大误差.
解答:解:方案一:
(1)坩埚中发生反应的化学方程式为:2NaHCO
3=Na
2CO
3+CO
2↑+H
2O
故答案为:2NaHCO
3=Na
2CO
3+CO
2↑+H
2O.保证NaHCO
3全部分解.
(2)该方案根据加热后残渣的质量来求解,要加热至恒重,以保证NaHCO
3全部分解.
故答案为:加热至恒重,以保证NaHCO
3全部分解.
方案二:
(1)碳酸钙沉淀会附着氯化钠、氯化钙,过滤后需用蒸馏水洗涤.
故答案为:用蒸馏水洗涤.
(2)沉淀经干燥后称量为m
2g,碳酸钙物质的量等于碳酸钠物质的量,所以碳酸钠的质量为
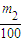
×106g,则该样品中碳酸钠的质量分数为

×100%=
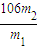
%.
故答案为:
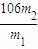
%.
(3)在一定量样品中加入足量Ca(OH)
2溶液,此时分别发生如下反应Na
2CO
3+Ca(OH)
2=CaCO
3↓+2NaOH,
NaHCO
3+Ca(OH)
2=CaCO
3↓+NaOH+H
2O,均产生CaCO
3沉淀,根据样品的总量和生成CaCO
3沉淀的量,可以计算碳酸钠质量,就可得出纯碱的质量分数.故用氢氧化钙溶液代替氯化钙溶液作沉淀剂,在其他操作正确的情况下,测得样品中的碳酸钠质量分数不变.
故答案为:不变.
方案三:
(1)C装置干燥二氧化碳,所以C中盛放的物质是浓硫酸.
(2)该方案关键是要获得产生的CO
2的质量,实验前容器内含有空气,空气中含有二氧化碳,会影响生成的二氧化碳的量,反应后装置中容器内含有二氧化碳,不能被C中碱石灰完全吸收,导致测定结果有较大误差,所以反应前后都要通入N
2,反应后通入N
2的目的是:排尽装置内的空气,将生成的二氧化碳从容器内排出,被D装置中碱石灰吸收.
故答案为:排尽装置内的空气,将生成的二氧化碳从容器内排出,被D装置中碱石灰吸收.
点评:以实验探究“工业纯碱(假设仅含碳酸氢钠杂质)中碳酸钠的质量分数”为载体,考查学生对于实验原理与装置理解评价、实验基本操作、化学计算等,难度中等,题目涉及到的小苏打和纯碱的化学知识是多方面的,构成了一道多角度的探究题.

 测定剩余固体质量
测定剩余固体质量 测定沉淀质量
测定沉淀质量 测定生成二氧化碳的质量
测定生成二氧化碳的质量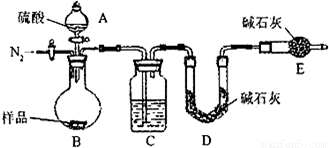
 ×106g,则该样品中碳酸钠的质量分数为
×106g,则该样品中碳酸钠的质量分数为 ×100%=
×100%=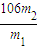 %.
%.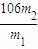 %.
%.

 (2009?厦门二模)纯碱是工业生产和日常生活中的重要物质.某兴趣小组为测定某工业纯碱(假设仅含碳酸氢钠杂质)中碳酸钠的质量分数,设计了下列三种实验方案进行探究.请填空:
(2009?厦门二模)纯碱是工业生产和日常生活中的重要物质.某兴趣小组为测定某工业纯碱(假设仅含碳酸氢钠杂质)中碳酸钠的质量分数,设计了下列三种实验方案进行探究.请填空:


 纯碱是工业生产和日常生活中的重要物质.某兴趣小组为测定某工业纯碱(假设仅含碳酸氢钠杂质)中碳酸钠的质量分数,设计了下列三种实验方案进行探究.请填空:
纯碱是工业生产和日常生活中的重要物质.某兴趣小组为测定某工业纯碱(假设仅含碳酸氢钠杂质)中碳酸钠的质量分数,设计了下列三种实验方案进行探究.请填空: 测定剩余固体质量
测定剩余固体质量
 测定沉淀质量
测定沉淀质量 测定生成二氧化碳的质量
测定生成二氧化碳的质量