
【题目】丙烯腈(CH2===CHCN)是一种重要的化工原料,工业上可用“丙烯氨氧化法”生产,主要副产物有丙烯醛(CH2===CHCHO)和乙腈(CH3CN)等。回答下列问题:
(1)以丙烯、氨、氧气为原料,在催化剂存在下生成丙烯腈(C3H3N)和副产物丙烯醛(C3H4O)的热化学方程式如下:
①C3H6(g)+NH3(g)+3/2O2(g)===C3H3N(g)+3H2O(g)ΔH=-515 kJ·mol-1
②C3H6(g)+O2(g)===C3H4O(g)+H2O(g)ΔH=-353 kJ·mol-1
有利于提高丙烯腈平衡产率的反应条件是__________;提高丙烯腈反应选择性的关键因素是________。
(2)图(a)为丙烯腈产率与反应温度的关系曲线,最高产率对应的温度为460 ℃。低于460 ℃时,丙烯腈的产率____(填“是”或“不是”)对应温度下的平衡产率,判断理由是________________;高于460 ℃时,丙烯腈产率降低的可能原因是________(双选,填标号)。
A.催化剂活性降低 B.平衡常数变大
C.副反应增多 D.反应活化能增大

(3)丙烯腈和丙烯醛的产率与n(氨)/n(丙烯)的关系如图(b)所示。由图可知,最佳n(氨)/n(丙烯)约为_____,理由是______________________________。进料气氨、空气、丙烯的理论体积比约为_________。
【答案】低温低压催化剂不是该反应为放热反应,平衡产率应随温度升高而降低,所以此时尚未达到平衡状态AC1:1此时产物主要是丙烯腈,几乎没有副产物1:7.5:1
【解析】
(1)改变条件使平衡正向进行有利于提高丙烯腈平衡产率,提高丙烯腈反应选择性的关键因素是催化剂;
(2)该反应为放热反应,平衡产率应随温度升高而降低,即低于460℃时,对应温度下的平衡转化率曲线应该是下降的,但实际曲线是上升的,因此判断低于460℃时,丙烯腈的产率不是对应温度下的平衡转化率;产率降低主要从产率的影响因素进行考虑;
(3)根据图象可知,当n(氨)/n(丙烯)约为1时,该比例下丙烯腈产率最高,而副产物丙烯醛产率最低;根据化学反应C3H6(g)+NH3(g)+3/2O2(g)=C3H3N(g)+3H2O(g),氨气、氧气、丙烯按1:1.5:1的体积比加入反应达到最佳状态,根据空气中氧气约占20%计算。
(1)气体体积增大的放热反应,降低温度、降低压强有利于提高丙烯腈的平衡产率,提高丙烯腈反应选择性的关键因素是催化剂;
(2)该反应为放热反应,平衡产率应随温度升高而降低,即低于460℃时,对应温度下的平衡转化率曲线应该是下降的,但实际曲线是上升的,因此判断低于460℃时,丙烯腈的产率不是对应温度下的平衡转化率。高于460°C时,丙烯腈产率降低。高于460 ℃时,丙烯腈产率降低的可能原因是
A.催化剂在一定温度范围内活性较高,若温度过高,活性降低,故A正确;
B.由图象可知,升高温度平衡常数变小,故B错误;
C.根据题意,副产物有丙烯醛,催化剂活性降低,副反应增多,导致产率下降,故C正确;
D.反应活化能的大小不影响平衡,故D错误;
故选AC;
(3)根据图象可知,当n(氨)/n(丙烯)约为1时,该比例下丙烯腈产率最高,而副产物丙烯醛产率最低;根据化学反应C3H6(g)+NH3(g)+3/2O2(g)=C3H3N(g)+3H2O(g),氨气、氧气、丙烯按1:1.5:1的体积比加入反应达到最佳状态,而空气中氧气约占20%,所以进料氨、空气、丙烯的理论体积约为1:7.5:1。


 中考解读考点精练系列答案
中考解读考点精练系列答案 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案科目:高中化学 来源: 题型:
【题目】随着原子序数的递増,八种短周期元素(用字母x、y、z…表示)的原子半径的相对大小、最高正价或最低负价的变化如下图所示。请根据判断出的元素回答下列问题

(1)f在元素周期表中的位置是第三周期第____族。
(2)比较d、e常见离子的半径大小:_______(用化学符号表示且用“>”连接,下同)。比较g、h的最高价氧化物对应的水化物的酸性强弱:_______
(3)写出x与z形成的常见四原子共价化合物的电子式_______
(4)物质A是一种常用的比水轻的有机溶剂,其仅由x、y两种元素组成,且y元素与x元素的质量比为12:1,A的相对分子质量为78。A与浓硫酸、浓硝酸在50~60℃下发生反应的化学方程式为__________,反应类型为__________。
(5)f的最高价氧化物对应的水化物可以与e的最高价氧化物对应的水化物反应,请写出该反应的离子方程式:_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量的混合气体在密闭容器中发生如下反应:xA(g)+yB(g)![]() zC(g),达到平衡后测得A气体的浓度为0.5 mol·L-1,保持温度不变,将密闭容器的容积压缩为原来的一半再次达到平衡后,测得A浓度为0.8 mol·L-1,则下列叙述正确的是( )
zC(g),达到平衡后测得A气体的浓度为0.5 mol·L-1,保持温度不变,将密闭容器的容积压缩为原来的一半再次达到平衡后,测得A浓度为0.8 mol·L-1,则下列叙述正确的是( )
A.平衡向正反应方向移动 B.x+y<z
C.B的物质的量浓度减小 D.C的体积分数降低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】处于平衡状态的反应2 H2 S(g) ![]() 2H2(g)+S2(g)
2H2(g)+S2(g) ![]() H>0,不改变其他条件的情况下合理的说法是
H>0,不改变其他条件的情况下合理的说法是
A.加入催化剂,反应途径将发生改变,![]() H也将随之改变
H也将随之改变
B.升高温度,正逆反应速率都增大,H2S分解率也增大
C.增大压强,平衡向逆反应方向移动,将引起体系温度降低
D.若体系恒容,注人一些H2后达新平衡,H2浓度将减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的化合物在生产、生活中广泛存在。
(1)键能是将1mol理想气体分子AB拆开为中性气态原子A和B所需的能量。已知下列化学键的键能如下表:

写出1mol气态肼(H2N-NH2)燃烧生成氮气和水蒸气的热化学方程式________________。
(2)用焦炭还原NO的反应为:2NO(g)+C(s)![]() N2(g)+CO2(g),向容积均为1L的甲、乙、丙三个恒容恒温(反应温度分别为400℃、400℃、T℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表所示:
N2(g)+CO2(g),向容积均为1L的甲、乙、丙三个恒容恒温(反应温度分别为400℃、400℃、T℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表所示:

①该反应为________(填“放热”或“吸热”)反应。
②乙容器在60min时达到平衡状态,则0~60min内用NO的浓度变化表示的平均反应速率v(NO)=____________。
(3)用焦炭还原NO2的反应为:2NO2(g)+2C(s) ![]() N2(g)+2CO2(g),在恒温条件下,1molNO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
N2(g)+2CO2(g),在恒温条件下,1molNO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
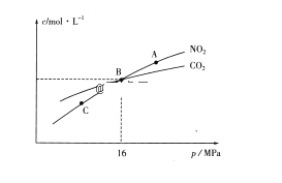
①A、C两点的浓度平衡常数关系:Kc(A)________Kc(C)(填“<”或“>”或“=”)。
②A、B、C三点中NO2的转化率最高的是________(填“A”或“B”或“C”)点。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】右图为某种乙醇燃料电池示意图,工作时电子流方向如图所示,下列判断正确的是

A.X为氧气
B.电极A反应式:CH3CH2OH-12e-+3H2O=2CO2+12H+
C.电极材料活泼性:A>B
D.B电极附近溶液pH增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黑火药是中国的“四大发明”之一.黑火药在发生爆炸时,发生如下的反应:2KNO3+3C+S═K2S+N2↑+3CO2↑.该反应中,被氧化的元素是______,氧化剂是______,氧化产物是______.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I、乙酸乙酯是重要的有机合成中间体,广泛应用于化学工业。实验室利用如图的装置制备乙酸乙酯。
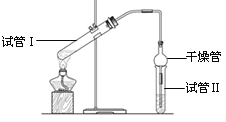
(1)与教材采用的实验装置不同,此装置中采用了球形干燥管,其作用是:_____________。
(2)请写出用CH3CH218OH制备乙酸乙酯的化学方程式:_____________,反应类型为_______。
(3)为了证明浓硫酸在该反应中起到了催化剂和吸水剂的作用,某同学利用上图所示装置进行了以下4个实验。实验开始先用酒精灯微热3min,再加热使之微微沸腾3min。实验结束后充分振荡小试管Ⅱ再测有机层的厚度,实验记录如下:
实验 编号 | 试管Ⅰ中的试剂 | 试管Ⅱ中的试剂 | 有机层的厚度/cm |
A | 2 mL乙醇、1 mL乙酸、 1mL18mol·L-1 浓硫酸 | 饱和Na2CO3溶液 | 3.0 |
B | 2 mL乙醇、1 mL乙酸 | 0.1 | |
C | 2 mL乙醇、1 mL乙酸、 3 mL 2mol·L-1 H2SO4 | 0.6 | |
D | 2 mL乙醇、1 mL乙酸、盐酸 | 0.6 |
①实验D的目的是与实验C相对照,证明H+对酯化反应具有催化作用。实验D中应加入盐酸的体积和浓度分别是______mL和_____mol·L-1 。
②分析实验_________________(填实验编号)的数据,可以推测出浓H2SO4的吸水性提高了乙酸乙酯的产率。
(4)若现有乙酸90g,乙醇138g发生酯化反应得到80g乙酸乙酯,试计算该反应的产率为______________(用百分数表示,保留一位小数)。
II、已知乳酸的结构简式为![]() 。试回答:
。试回答:
①乳酸分子中的官能团有:_____________________________________(写名称);
②乳酸与足量金属钠反应的化学方程式为________________________________;
③已知—COOH不会发生催化氧化,写出加热时,乳酸在Cu作用下与O2反应的化学方程式:________________________________________________;
④腈纶织物产泛地用作衣物、床上用品等。腈纶是由CH2=CH-CN聚合而成的。 写出在催化剂、加热条件下制备腈纶的化学方程式________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com