
【题目】某化学小组研究在其他条件不变时,改变密闭容器中某一条件对A2(g)+3B2(g)2AB3(g)化学平衡状态的影响,得到如图所示的曲线(图中T表示温度,n表示物质的量)下列判断正确的是
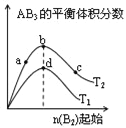
A. 图中T2一定大于T1
B. 图中b点速率一定大于d点速率
C. 达到平衡时,A2的转化率大小为:c>b>a
D. 加入催化剂可以使状态d变为状态b
 星级口算天天练系列答案
星级口算天天练系列答案科目:高中化学 来源: 题型:
【题目】1×105Pa、298K时,2mol氢气燃烧生成水蒸气放出484kJ热量,下列热化学方程式正确的是( )
A.H2O(g) = H2(g) + 1/2O2(g) △H= +242kJ·mol-1
B.2H2(g) + O2(g) = 2H2O(l) △H= +484kJ·mol-1
C.H2(g) + 1/2O2(g) = H2O(g) △H= +242kJ·mol-1
D.2H2(g) + O2(g) = 2H2O(g) △H= +484kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知H2O2、KMnO4、NaClO、K2Cr2O7均具有强氧化性。将溶液中的Cu2+、Fe2+、Fe3+沉淀为氢氧化物,需溶液的pH分别为6.4、9.6、3.7。现有含FeCl2杂质的氯化铜晶体(CuCl2·2H2O),为制取纯净的CuCl2·2H2O,首先将其制成水溶液,然后按图示步骤进行提纯:
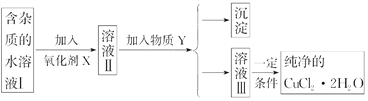
请回答下列问题:
(1)本实验最适合的氧化剂X是________(填序号)。
A.K2Cr2O7 B.NaClO
C.H2O2 D.KMnO4
(2)物质Y是________。
(3)除去Fe3+的有关离子方程式是____________________、_______________________。
(4)加氧化剂的目的是____________________________________________。
(5)最后能不能直接蒸发结晶得到CuCl2·2H2O晶体?________,应如何操作?_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是
A. CuCl2溶液蒸干灼烧后得到CuCl2固体
B. 火力发电的目的是使化学能转换为电能
C. 已知C(石墨,s)= C(金刚石,s)△H>0,无法比较二者的稳定性
D. 将FeCl3固体溶于适量蒸馏水来配制FeCl3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对某难溶电解质AnBm的饱和溶液中,下列说法正确的是
A. 加同温度的水,其溶度积减小、溶解度增大
B. 升高温度,它的溶解度和溶度积都增大
C. 饱和溶液中c(Am+)=c(Bn﹣)
D. 加同温度的水,其溶度积、溶解度均不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中进行反应:X2(g)+Y2(g)2Z(g),已知X2、Y2、Z起始浓度分别为0.1mol/L、0.3mol/L、0.2mol/L,在一定条件下,当反应达到平衡时,各物质的浓度可能是
A. c(Z)=0.4 mol/L B. c(X2)=0.2mol/L
C. c(Y2)=0.4mol/L D. c(X2)+c(Y2)+c(Z)=0.6mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物的结构如图所示,下列说法正确的是
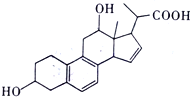
A. 该有机物的分子式为C21H24O4
B. 该有机物共有四种官能团,分别是:羟基、羧基、苯环、碳碳双键
C. 该有机物最多消耗NaOH与NaHCO3的物质的量比为1:1
D. 1mol 该有机物与足量金属钠反应,生成33.6L氢气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)氨的合成是最重要的化工生产之一,工业上合成氨用的H2有多种制取的方法。用天然气跟水蒸气反应:CH4(g)+H2O(g)![]() CO(g)+3H2(g)。已知有关反应的能量变化如下图所示,则此制取H2反应的ΔH=____________。
CO(g)+3H2(g)。已知有关反应的能量变化如下图所示,则此制取H2反应的ΔH=____________。
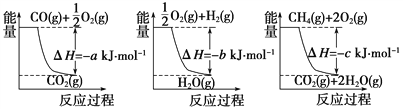
(2)已知通常状况下,每充分燃烧1gCO并恢复到原状态,会释放10KJ的热量。请写出表示CO燃烧热的热化学反应方程式:________________________________。
(3)一种甲烷燃料电池是采用铂或碳化钨作为电极催化剂,在稀硫酸电解液中直接通入甲烷,同时向一个电极通入空气。此电池的负极电极反应式是_______________。
(4)利用右图装置可以模拟铁的电化学防护。
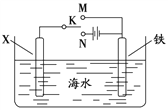
① 若X为碳棒,为减缓铁的腐蚀,开关K应置于______处。假设海水中只有NaCl溶质,写出此时总离子反应方程式:__________________________________________。
② 若X为锌,开关K置于M处,该电化学防护法称为_________。写出铁电极处的电极反应式:_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用电解法处理含镍酸性废水并得到单质镍的原理如图所示。下列说法错误的是

已知:①Ni2+在弱酸性溶液中发生水解;
②氧化性:Ni2+(高浓度)>H+>Ni2+(低浓度)
A. 碳棒上发生的电极反应:4OH4e= O2↑+2H2O
B. 为了提高镍的产率,电解过程中需要控制废水的pH
C. 电解过程中,B中NaCl溶液的物质的量浓度将不断减少
D. 若将图中阳离子膜去掉,将A、B两室合并,则电解反应总方程式发生改变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com