
【题目】工业上用电解法处理含镍酸性废水并得到单质镍的原理如图所示。下列说法错误的是

已知:①Ni2+在弱酸性溶液中发生水解;
②氧化性:Ni2+(高浓度)>H+>Ni2+(低浓度)
A. 碳棒上发生的电极反应:4OH4e= O2↑+2H2O
B. 为了提高镍的产率,电解过程中需要控制废水的pH
C. 电解过程中,B中NaCl溶液的物质的量浓度将不断减少
D. 若将图中阳离子膜去掉,将A、B两室合并,则电解反应总方程式发生改变
【答案】C
【解析】A、由图知,碳棒与电源正极相连是电解池的阳极,电极反应4OH4e= O2↑+2H2O,A正确;B、因Ni2+在弱酸性溶液中易发生水解;氧化性:Ni2+(高浓度)>H+>Ni2+(低浓度),为了提高Ni的产率,电解过程中需要控制废水pH,B正确;C、镀镍铁棒与电源负极相连是电解池的阴极,电极反应Ni2++2e-=Ni。电解过程中为平衡A、C中的电荷,A中的Na+和C中的Cl-分别通过阳离子膜和阴离子膜移向B中,这使B中NaCl溶液的物质的量浓度不断增大,C错误;D、若将图中阳离子膜去掉,由于放电顺序Cl->OH-,则Cl-移向阳极放电:2Cl--2e-=Cl2↑,电解反应总方程式会发生改变,D正确;答案选C。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】工业上可用软锰矿浆(主要成分为MnO2)吸收硫酸厂的废气SO2,并制备
MnSO4·H2O晶体,其工艺流程如下:

已知:①浸出液的pH<2,其中的金属阳离子主要是Mn2+,还有少量Fe2+、Al3+等。
②几种离子沉淀时数据信息如下:
离子 | Fe2+ | Fe3+ | Al3+ | Mn2+ |
开始沉淀时pH | 7.6 | 2.7 | 3.8 | 8.3 |
完全沉淀时pH | 9.7 | 4.0 | 4.7 | 9.8 |
请回答下列问题:
(1)加入MnO2氧化时溶液中反应的离子方程式为_______________________________。
(2) 若流程中取消“加入MnO2”,对上述流程的影响是____________________________。
(3)试剂X能否选用碳酸锰(MnCO3)或氢氧化锰[Mn(OH)2],判断并说明理由: ________。
(4)滤渣的主要成分是________,利用滤渣能提取铁红,其原理是___________________。
(5)从滤液中提取MnSO4·H2O晶体的操作是___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】羟基扁桃酸是药物合成的重要中间体,它可由苯酚和乙醛酸反应制得
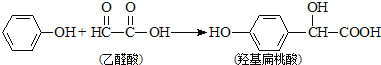
下列有关说法正确的是
A. 苯酚和羟基扁桃酸互为同系物
B. 标准状况下,22.4L羟基扁桃酸中共用电子对的数目为24NA
C. 乙醛酸只存在一种不同环境的氢原子
D. 羟基扁桃酸分子中至少有12个原子共平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 可将气态废弃物中的硫化氢转化为可利用的硫,自身还原为
可将气态废弃物中的硫化氢转化为可利用的硫,自身还原为![]() 。工业上常采用如图所示的电解装置,通电电解,然后通入
。工业上常采用如图所示的电解装置,通电电解,然后通入![]() 加以处理。下列说法不正确的是 ( )
加以处理。下列说法不正确的是 ( )

A. 电解时阳极反应式为![]() ]
]
B. 电解时阴极反应式为![]()
C. 当电解过程中有标准状况下 22. 4L 的![]() 生成时,溶液中有 32g S析出(溶解忽略不计)
生成时,溶液中有 32g S析出(溶解忽略不计)
D. 整个过程中需要不断补充![]() 与
与![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.在标准状况下,1mol水的体积是22.4L
B.1molH2所占的体积一定是22.4L
C.在标准状况下,NA个任何分子所占的体积约为22.4L
D.在标准状况下,28g的N2体积约为22.4L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组同学为探究同周期或同主族元素性质的递变规律,设计了如下系列实验:
利用下图装置来验证同主族元素非金属性的变化规律:
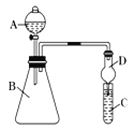
(1)要证明非金属性:Cl>I,在A中加浓盐酸,B中加KMnO4(KMnO4与浓盐酸常温下反应生成氯气),C中加淀粉碘化钾混合溶液,观察到C中溶液________________的现象,即可证明。干燥管D的作用是___________________。从环境保护的角度考虑,此装置尚缺少尾气处理装置,可用___________溶液吸收尾气。
(2)要证明非金属性:C>Si,在A中加盐酸,B中加CaCO3,C中加Na2SiO3溶液,将观察到C中______________的现象。但老师认为,该现象不足以证明酸性强弱关系为碳酸>硅酸,请用文字叙述理由_______________________________。
因此应在B、D之间增加一个盛有足量____(选填下列字母:A.浓盐酸 B.浓NaOH溶液C.饱和Na2CO3溶液 D.饱和NaHCO3溶液)的洗气装置。
改进后C中发生反应的化学方程式是___________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com