
【题目】苯及其同系物是现代居室污染物的主要来源。回答下列问题:
(1)写出分子式为C6H6的一种含碳碳三键且无支链的链烃的结构简式:_________。
(2)已知1,3-环己二烯(![]() )脱去2 mo1H 变成苯放出热量。则苯比1,3-环己二烯_____________(填“稳定”或“不稳定”)。
)脱去2 mo1H 变成苯放出热量。则苯比1,3-环己二烯_____________(填“稳定”或“不稳定”)。
(3)苯的凯库勒式不能解释的事实是______(填字母)。
a.苯不能使溴水褪色
b.苯能与 H2发生加成反应
c.溴苯没有芳香族类同分异构体
d.邻二溴苯只有一种
(4)现代化学认为苯分子中碳碳之间的键是__________,故苯分子既能发生取代反应又能发生加成反应。
(5)甲苯是苯的同系物。甲苯_________(填“能”或“否”)使酸性高猛酸钾溶液褪色;甲苯与混合酸在加热条件下生成三硝基甲苯的反应方程式为_____________。
【答案】HC≡C—C≡C—CH2—CH3或HC≡C—CH2—C≡C—CH3或HC≡C—CH2—CH2—C≡CH或CH3—C≡C—C≡C—CH3 稳定 ad 介于单键和双键之间特殊的共价键 能 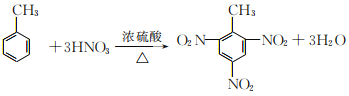
【解析】
(1)C6H6比饱和碳链(C6H14)少8个H,刚好为4个不饱和度,若含碳碳三键且无支链的链烃,则分子中含有2个三键,可能的情况为:HC≡C—C≡C—CH2—CH3、HC≡C—CH2—C≡C—CH3、HC≡C—CH2—CH2—C≡CH、CH3—C≡C—C≡C—CH3,故答案为HC≡C—C≡C—CH2—CH3或HC≡C—CH2—C≡C—CH3或HC≡C—CH2—CH2—C≡CH或CH3—C≡C—C≡C—CH3;
(2)1,3环已二烯脱去2mol氢原子变成苯放热,说明苯的总能量比1,3环已二烯低,物质的能量越低,越稳定,故答案为:稳定;
(3)1866年凯库勒提出了苯的单、双键交替的正六边形平面结构,如果含有C=C键的话,则能发生加成反应而使溴水褪色,但真实的情况是苯不能使溴水应发生反应而褪色,这一点不能解释,再就是如果是单双建交替的正六边形平面结构,则邻二溴苯应有Br—C—C—Br和Br—C=C—Br两种不同的结构,但事实是邻二溴苯只有一种,这一点也不能解释,故答案为ad;
(4)苯分子中含有一种特殊的化学键,键长介于C—C和C=C之间,不存在单纯的单、双键,是介于碳碳单键和碳碳双键之间的特殊的键,故答案为:介于碳碳单键和碳碳双键之间的特殊的键;
(5) 甲苯是苯的同系物,能与酸性高锰酸钾反应生成苯甲酸,故甲苯能使酸性高锰酸钾溶液褪色,甲苯与混合酸在加热条件下生成三硝基甲苯,硝基取代苯环上的邻间对位的氢原子,反应方程式为 ,故答案为:能;
,故答案为:能; 。
。


科目:高中化学 来源: 题型:
【题目】到目前为止,由化学能转变的热能或电能仍然是人类使用的最主要的能源。
(1)在25℃、101kPa下,16g的甲醇(CH3OH)完全燃烧生成CO2和液态水时放出352kJ的热量,则表示甲醇燃烧热的热化学方程式为______。
(2)化学反应中放出的热能(焓变,△H)与反应物和生成物的键能(E)有关。已知:H2(g)+Cl2(g)=2HCl(g) △H=﹣185kJ/mol,E(H﹣Cl)=432kJ/mol,E(Cl﹣Cl)=243kJ/mol则E(H﹣H)=_____。
(3)纳米级Cu2O由于具有优良的催化性能而受到关注.已知:2Cu(s)+ ![]() O2(g)═Cu2O(s)△H=﹣169kJmol﹣1,C(s)+
O2(g)═Cu2O(s)△H=﹣169kJmol﹣1,C(s)+ ![]() O2(g)═CO(g)△H=﹣110.5kJmol﹣1,2Cu(s)+O2(g)═2CuO(s)△H=﹣314kJmol﹣1,则工业上用炭粉在高温条件下还原CuO制取Cu2O和CO的热化学方程式_____。
O2(g)═CO(g)△H=﹣110.5kJmol﹣1,2Cu(s)+O2(g)═2CuO(s)△H=﹣314kJmol﹣1,则工业上用炭粉在高温条件下还原CuO制取Cu2O和CO的热化学方程式_____。
(4)如图是N2(g)和H2(g)反应生成2molNH3(g)过程中能量变化示意图:
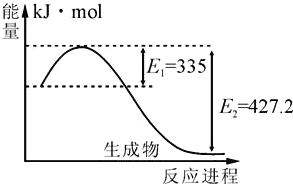
①请计算每生成1molNH3放出热量为:______。
②若起始时向容器内充入1molN2和3molH2达平衡后N2的转化率为20%,则反应放出的热量为Q1kJ,则Q1的数值为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1980年,古迪的夫发明了钴酸锂材料,这种材料的结构可以使锂离子在其中快速移动。以LiCoO2作电极材料的锂离子电池在充、放电时的微观粒子变化如图所示,下列说法正确的是
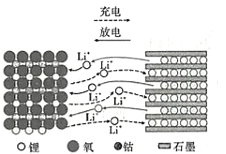
A.LiCoO2是电池的负极材料
B.充电时,LiCoO2电板的电势低于石墨电极
C.充电时,阳极发生的反应是LiCoO2+xe-=Li1-xCoO2+xLi+
D.放电时,当1mol电子转移,则石墨电极质量减少7g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】端炔烃在催化剂的存在下可发生偶联反应,称为Glaser反应。
2R—C≡C—H![]() R—C≡C—C≡C—R+H2
R—C≡C—C≡C—R+H2
该反应在研究新型发光材料、超分子化学等方面具有重要价值。下面是利用Glaser反应由苯A制备化合物E的一种合成路线:


回答下列问题:
(1)B的结构简式为________,D的化学名称为________。
(2)①和③的反应类型分别为________、________。
(3)E的结构简式为____________________。1 mol E与氢气反应,理论上最多消耗氢气________ mol。
(4)芳香化合物F是C的同分异构体,其分子中只有两种不同化学环境的氢,数目比为3∶1,则符合条件的同分异构体有______种。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某分子的结构如图所示(-R 为烃基),其中 A、B、D 三种元素位于元素周期表中同一族的三个相邻的周期,A 的非金属性大于 B。D 与 G 形成的 DG3 在工业上可用于漂白和杀菌消毒。A 与 G 形成的 AG3 可完全水解,其水解的产物之一 H3AO3 常用作塑料件镀金属的还原剂。
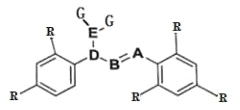
(1)具有未成对电子的原子或分子具有磁性。D 的某种氧化物 D2O4 的磁性大小与温度呈正相关关系,即磁性是温度的增函数。则 D2O4 ![]() 2DO2,ΔH______0(填“>”“<”或“=”)。
2DO2,ΔH______0(填“>”“<”或“=”)。
(2)DG3 用于杀菌消毒与 HGO 相比,DG3 可大大延长杀菌消毒的时间,试从反应速率理论和平衡移动理论两者中选择一个,解释其原因____________________________。
(3)无机含氧酸中的非羟基氢不能发生电离。H3AO3 分子中 A 原子最外层的电子都参与了共价键的形成,试用方程式表示 H3AO3 的正盐溶液呈碱性的原因_____。
(4)液氨中因存在2NH3(1) ![]() NH4++NH2-可导电,液态 D2O4 中也存在 D2O4
NH4++NH2-可导电,液态 D2O4 中也存在 D2O4![]() DO++DO3-,上述两个过程的本质区别为___________。
DO++DO3-,上述两个过程的本质区别为___________。
(5)T℃时,在一体积为 VL 的密闭容器中放入一定量的 ACl5 固体,按下式发生反应:ACl5(s)![]() ACl3(g)+Cl2(g),ΔH>0。测得容器内气体的压强变化如下表:
ACl3(g)+Cl2(g),ΔH>0。测得容器内气体的压强变化如下表:
时间 t/s | 0 | 5 | 10 | 15 | 20 | 25 | 30 | ∞ |
总压 P/kPa | 0 | 1.0 | 2.0 | 3.0 | 4.0 | 5.0 | 5.0 | 5.0 |
上述条件下,以分压表示的平衡常数 Kp=_____(kPa)2(计算结果保留两位小数); 若保持温度不变,30s 时给容器加压,达新平衡后,容器内的总压将_____(填“升高”、“降低”或“不变”);若将容器换成绝热容器,加压后容器内的总压将_____(填“升高”、“降低”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图均是由4个碳原子结合成的五种有机物(氢原子没有画出) 回答下列问题:

(1)空间结构为正四面体的化学式为___________________。
(2)五种物质中属于烯烃的是 ________(填字母,下同)。
(3)与e互为同分异构体的是_____________________。
(4)五种物质中4个碳原子一定处于同一平面的有_______________。
(5)写出b的一种同分异构体的结构简式:_____________________(C除外)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁及其化合物广泛存在于人们的日常生活和工业生产中。回答下列问题:
(1)基态Fe原子的核外电子排布式是________,Ca元素与Fe元素同周期,灼烧![]() ,火焰为砖红色,节日中燃放的焰火配方中常含有Ca元素,灼烧Ca元素呈现特殊颜色的原因是____
,火焰为砖红色,节日中燃放的焰火配方中常含有Ca元素,灼烧Ca元素呈现特殊颜色的原因是____
(2)人体内血红蛋白的结构简式如图所示:
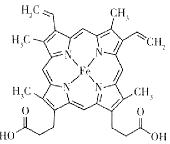
①组成血红蛋白的5种元素中,电负性由大到小的顺序是_________,C、N、O的第一电离能由大到小的顺序是_______。
②血红蛋白分子结构中N的杂化方式是_______。
③血红蛋白分子结构中含有配位键,为这些配位键提供孤电子对的元素是_______(写元素符号,下同),提供空轨道的元素是______。
(3)![]() 可应用于工业生产中的催化剂,其晶胞结构如图所示:
可应用于工业生产中的催化剂,其晶胞结构如图所示:
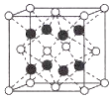
①已知电负性:Fe-1.83,Br-2.96,则![]() 中含有的化学键类型为_________。
中含有的化学键类型为_________。
②![]() 晶胞中铁的配位数是_________;
晶胞中铁的配位数是_________;![]() 晶胞边长为a cm,则
晶胞边长为a cm,则![]() 晶体密度的表达式为_____________
晶体密度的表达式为_____________![]() (设阿伏加德罗常数的值为NA)。
(设阿伏加德罗常数的值为NA)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知常温下H2A的K1=1.0×10-4,K2=5.0×10-7。向20mLlmol·L-1的H2A溶液中逐滴滴入2mol·L-1的NaOH溶液,溶液中水电离出的c水(OH-)随加入NaOH溶液的体积V的变化如图所示,下列分析正确的是( )
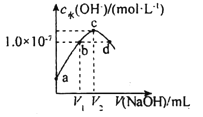
A.V1<10,V2=20
B.a点溶液的pH=3
C.c点溶液c水(H+)≈1.0×10-4mol·L-1
D.b、d点溶液均呈中性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁电池因具有高的安全性和低廉的价格而备受关注,我国科学 家最近研发出一种新型镁电池,其工作原理如图所示。下列说法正确的是

A.I 室中的电解质溶液可以是稀 H2SO4
B.外电路中转移 2mol 电子时,N 极质量增加 24a g
C.离子交换膜为阳离子交换膜
D.电子流向:M 电极→I 室→离子交换膜→II 室→N 极
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com