
����Ŀ������ʱ����2molA��2molB����Ͷ��̶��ݻ�Ϊ2L�ܱ������з�����Ӧ��2A��g��+ B��g��![]() xC��g��+D��s����10sʱ�����A�����ʵ���Ϊ1.7mol��C�ķ�Ӧ����Ϊ0.0225mol��L��1��s��1��40sʱ��Ӧǡ�ô���ƽ��״̬����ʱB��ת����Ϊ20%������д���пհף�
xC��g��+D��s����10sʱ�����A�����ʵ���Ϊ1.7mol��C�ķ�Ӧ����Ϊ0.0225mol��L��1��s��1��40sʱ��Ӧǡ�ô���ƽ��״̬����ʱB��ת����Ϊ20%������д���пհף�
��1��x = _________________
��2���ӷ�Ӧ��ʼ��10s��B��ƽ����Ӧ����Ϊ______________
��3��ƽ��ʱ������B���������Ϊ___________________
��4�����¶��´˷�Ӧ��ƽ�ⳣ������ʽΪ_______________
��5�����и����ܱ�ʾ�÷�Ӧ�ﵽƽ��״̬��_____________
A������A�����ʵ���������D�����ʵ���֮��Ϊ2��1
B��������A��B�����ʵ��� n(A)��n(B) = 2��1
C�������ƽ����Է����������ٱ仯
D��ѹǿ���ٱ仯
E����������ʵ������ٱ仯
���𰸡� 3 0.0075 mol(L��s)��1 40% ![]() C
C
��������(1)10s����n(A)=2mol-1.7mol=0.3mol����n(C)=0.0225molL-1s-1��10s��2L=0.45mol�����ʵ����仯��֮�ȵ��ڻ�ѧ������֮�ȣ���2��x=0.3mol��0.45mol�����x=3���ʴ�Ϊ��3��
(2)��������֮�ȵ��ڻ�ѧ������֮�ȣ���v(B)= ![]() v(C)=
v(C)= ![]() ��0.0225molL-1s-1=0.0075molL-1s-1���ʴ�Ϊ��0.0075molL-1s-1��
��0.0225molL-1s-1=0.0075molL-1s-1���ʴ�Ϊ��0.0075molL-1s-1��
(3)40sʱ��Ӧǡ�ô���ƽ��״̬����ʱB��ת����Ϊ20%����Ӧ��BΪ2mol��20%=0.4mol��ƽ��ʱBΪ2mol-0.4mol=1.6mol����Ӧǰ������������ʵ������䣬��B���������Ϊ![]() ��100%=40%���ʴ�Ϊ��40%��
��100%=40%���ʴ�Ϊ��40%��
(4)2A(g)+B(g) ![]() xC (g)+D(s)�Ļ�ѧƽ�ⳣ������ʽK=
xC (g)+D(s)�Ļ�ѧƽ�ⳣ������ʽK=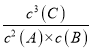 ���ʴ�Ϊ��
���ʴ�Ϊ��  ��
��
(5)A������A�����ʵ���������D�����ʵ���֮��ʼ��Ϊ2��1������˵������ƽ�⣬��A����B��ƽ��ʱ��������ʵ���֮�Ȳ�һ�����ڻ�ѧ������֮�ȣ���A��B��ʼ���ʵ���Ϊ1��1�����߰�2��1��Ӧ��ƽ��ʱ�������ʵ���֮�Ȳ�����Ϊ2��1����B����C����Ӧǰ�����������ʵ������䣬�淴Ӧ������������������С�������ƽ����Է����������ٱ仯��˵������������������䣬��Ӧ����ƽ�⣬��C��ȷ��D��x=3����Ӧǰ�����������ʵ������䣬���º����£�ѹǿʼ�ղ��䣬����˵���ﵽ��ƽ��״̬����D����E��x=3���÷�Ӧ������������ʵ�������ķ�Ӧ�����ʵ���ʼ�ղ��䣬����˵���ﵽ��ƽ��״̬����E����ѡC��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ�˳�ȥ�����е�Ca2+��Mg2+��SO42-����ɳ���ɽ������ܽ���ˮ��Ȼ�������������������ٹ��� �ڼӹ���NaOH��Һ �ۼ��������� �ܼӹ���Na2CO3��Һ �ݼӹ���BaCl2��Һ����ȷ���ǣ� ��
A.�٢ܢڢݢ٢�B.�٢ܢݢڢ٢�C.�٢ڢݢܢ٢�D.�٢ڢܢݢ٢�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ٴ����õ���ѹҩ����һ�ֺϳ�·�����£�
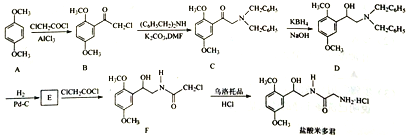
��1����������к�������������Ϊ_____________(ֻд����)��
��2��B��C�ķ�Ӧ����Ϊ___________��
��3��д����������������B��һ��ͬ���칹��Ľṹ��ʽ��_______��
�ٺ��б�������������һ������̼ԭ�ӣ��ܷ���������Ӧ����FeCl3��Һ������ɫ��Ӧ��������������ˮ������������л��
�ڷ�����ֻ��5�ֲ�ͬ��ѧ�������⡣
��4��E�ķ���ʽΪC10H15O3N����ȡ���õ�F��д��E�Ľṹ��ʽ��_______��
��5����֪��![]() ����д����
�������![]() ��
��![]() Ϊԭ���Ʊ�
Ϊԭ���Ʊ�![]() �ĺϳ�·������ͼ______�����Լ����ã��ϳ�·������ͼʾ����������ɣ���
�ĺϳ�·������ͼ______�����Լ����ã��ϳ�·������ͼʾ����������ɣ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ȫ������Զ��Բ������缫���ڵ������Һ�з����ĵ���ܷ�ӦΪ��VO2������ɫ����H2O��V3������ɫ��![]() VO2������ɫ����V2������ɫ����2H������˵��������ǣ� ��
VO2������ɫ����V2������ɫ����2H������˵��������ǣ� ��
A. �ŵ�ʱ��������ӦΪVO2++2H����e����VO2����H2O
B. �ŵ�����У�����������Һ�����Լ���
C. ���ʱ������������Һ����ɫ��Ϊ��ɫ
D. ���ʱ����Ӧÿ����2mol H��ʱ����ת����Ϊ2mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1����ͭƬ����Ƭ����ʢ��ϡʳ��ˮ�ͷ�̪���Һ��U�ι��У���ͼ��ʾ�����տ���A���۲쵽��̪��졣���������⣺
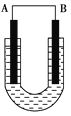
��A��ԭ��ص�_______������������____(����ͭ����������)��
���缫����ʽ�ֱ�Ϊ������______________________��ԭ��ط�ӦΪ_____________________________________��
��2�����ͼ��ѡ����Ҫ��װ�ý��е�ⱥ��ʳ��ˮ��ʵ�飬Ҫ��ⶨ���������������(����25 mL)�������������������ԡ�
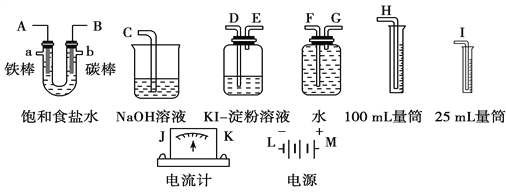
��A�������ĵ缫��Ӧʽ��________________��B�������ĵ缫��Ӧʽ��_______________��
�������������ʵ��װ��ʱ�����ӿڵ���ȷ����˳��Ϊ_________________________________________________________��
��ʵ���У���ʢ��KI������Һ�������з�����Ӧ�����ӷ���ʽΪ______________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������Ϊ����Խ��Խ���ĵĻ������⡣�����к��ж�������������Ϳ�������������Ⱦ�����ʡ���ش��������⣺
��1������β���������γɵ�ԭ��֮һ��β���������������лӷ��������������ʣ�CxHy������ԭβ���е�NO���壬�ù��̵Ļ�ѧ����ʽΪ___________________��
��2������ȼú��ů�����ķ���Ҳ����������Ҫ��Դ֮һ�����о����ֽ�ú̿��O2/CO2��������ȼ�գ��ܹ�����ȼúʱNO���ŷţ���Ҫ��ӦΪ��
2NO(g)��2CO(g)![]() N2(g)��2CO2(g) ��H
N2(g)��2CO2(g) ��H
��֪����N2(g)��O2(g)![]() 2NO(g) ��H1����180.5 kJ��mol-1
2NO(g) ��H1����180.5 kJ��mol-1
��2CO(g)![]() 2C(s)��O2(g) ��H2����221 kJ��mol-1
2C(s)��O2(g) ��H2����221 kJ��mol-1
��C(s)��O2(g)![]() CO2(g) ��H3����393.5 kJ��mol-1
CO2(g) ��H3����393.5 kJ��mol-1
����H��_____________��
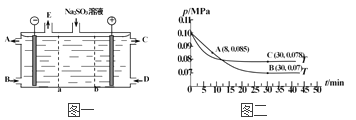
��3��ij�о�С����NaOH��Һ����β���еĶ��������õ���Na2SO3��Һ���е�⣬��������Ĥ��ϵ��װ����ͼһ��ʾ���缫����Ϊʯī��
��a��ʾ_____���ӽ���Ĥ����������������������A��E�ֱ���������е�ԭ�ϻ��Ʒ������CΪ���ᣬ��A��ʾ_________��E��ʾ___________��
�������ĵ缫��ӦʽΪ___________________________��
 ����
����
��4��SO2�����������������Ͻ��д���������ȡ����������SO2�����������ķ�ӦΪ��2SO2(g)��O2(g)![]() 2SO3(g)������T1����0.1 MPa�����£���һ�ܱ�����ͨ��SO2��O2������n(SO2) ��n(O2)��2��1�ݣ������������ѹǿ�뷴Ӧʱ����ͼ����ʾ��
2SO3(g)������T1����0.1 MPa�����£���һ�ܱ�����ͨ��SO2��O2������n(SO2) ��n(O2)��2��1�ݣ������������ѹǿ�뷴Ӧʱ����ͼ����ʾ��
��ͼ��A��ʱ��SO2��ת����Ϊ____________��
���������������������£����T2��ʱѹǿ�ı仯������ͼ��ʾ����C�������Ӧ����vc(��)��A����淴Ӧ����vA(��)�Ĵ�С��ϵΪvc(��)______vA(��)������������������������������
��ͼ��B���ѹǿƽ�ⳣ��Kp��_______________����ƽ���ѹ����ƽ��Ũ�ȼ��㣬��ѹ����ѹ�����ʵ�����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������±���������ܷ���ˮ�⣬���ܷ�����ȥ��Ӧ��ֻ�ܵõ�һ�ֵ�ϩ������
A.  B.
B. 
C.  D.
D. 
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(F)����Ҫ��ҽҩ�м��壬���Ʊ�������ͼ����ʾ��

��֪��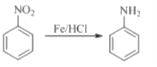
�ش��������⣺
��1��B��������___________��F�й����ŵ�����Ϊ___________��
��2��д��������������B��ͬ���칹��Ľṹ��ʽ___________��
a��������ֻ������ȡ�����һ�Ϊ��λ
b�����ܷ���������Ӧ���ܷ���ˮ�ⷴӦ
��3��������δ���üױ�ֱ�������ķ����Ʊ�B,���Ǿ��ɢ٢ڢ�������Ӧ��ȡB����Ŀ����_______________��
��4��д���Ļ�ѧ��Ӧ����ʽ_____________________________________��
��5��д����ķ�Ӧ�Լ�������__________________________��
��6����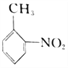 �ϳ�
�ϳ� �����̣�___________________________________________��
�����̣�___________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������̼�����Ҫ����ʳƷ��ҽҩ����ҵ���Ծ�ѡʯ��ʯ����������MgCO3��FeCO3���ʣ�Ϊԭ���Ʊ�����̼��ƵĹ����������£�

��1�������п���ѭ�����õ������������������__________���ѧʽ����
��2����̼����ʱ������Ӧ�����ӷ���ʽΪ________________���ù�����ͨ��������������˳����________________��
��3����ҵ�ϳ��õ���Ȼ��ƺ��Ȼ������������Ʊ������ƣ�ԭ������ͼ��ʾ��

�ٵ������У������Ȼ��Ƶ�Ŀ����________________��
��ʯī�缫�����ĵ缫��Ӧ����ʽΪ________________��
�۵��õ���Na��Լ��1%��Ca����ȥ��������Ca�ķ���Ϊ________________��
��֪�������ʵ��۷е����±���

�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com