
 如图是一套检验气体的实验装置示意图,向装置中缓慢通入气体X,若关闭活塞K,则品红溶液无变化而澄清石灰水变浑浊:若打开活塞K,则品红溶液褪色.根据此现象判断,X和Y可能是( )
如图是一套检验气体的实验装置示意图,向装置中缓慢通入气体X,若关闭活塞K,则品红溶液无变化而澄清石灰水变浑浊:若打开活塞K,则品红溶液褪色.根据此现象判断,X和Y可能是( )| A. | X:SO2,Y:饱和NaHCO3溶液 | B. | X:Cl2,Y:饱和Na2SO3溶液 | ||
| C. | X:HCl,Y:饱和NaHSO3溶液 | D. | X:CO2,Y:饱和Na2CO3溶液 |
分析 能使品红褪色的气体可能为SO2、NO2和Cl2,二氧化碳和二氧化硫都能使澄清石灰水变浑浊,以此来解答.
解答 解:若打开活塞K,品红溶液褪色,X气体只可能是SO2、NO2或Cl2;
A.如果X是二氧化硫,Y是饱和NaHCO3溶液,二氧化硫能漂白品红溶液,二氧化硫能和碳酸氢钠反应生成二氧化碳,二氧化碳能使澄清石灰水变浑浊,符合题意,故A选;
B.如果X是氯气,Y是饱和亚硫酸钠,氯气和水反应生成的盐酸能和亚硫酸钠反应生成二氧化硫,二氧化硫能使品红溶液,则关闭K,品红仍然褪色,不符合题意,故B不选;
C.如果X是HCl,打开K时,HCl不能使品红褪色,不符合题意,故C不选;
D.二氧化碳不能使品红溶液褪色,不符合题意,故D不选;
故选A.
点评 本题考查气体的性质及实验装置综合,为高频考点,明确物质的性质是解本题关键,侧重考查学生分析及知识运用能力,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题

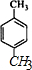
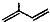 命名为2-甲基-1,3-丁二烯.
命名为2-甲基-1,3-丁二烯.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N2、H2、NH3的浓度不再变化 | B. | N2、H2、NH3的浓度为1﹕3﹕2 | ||
| C. | N2、H2、NH3在密闭容器中共存 | D. | 反应停止,正、逆反应速率都等于0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 与足量酸性高锰酸钾反应 | B. | 依次通入通入足量溴水和浓硫酸中 | ||
| C. | 在一定条件下通入H2 | D. | 分别进行燃烧 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
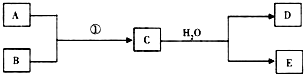 (1)若条件①为点燃,目前60%的B都是从海水中提取的,气体D可以使湿润的红色石蕊试纸变蓝,写出C与H2O反应的化学方程式Mg3N2+6H2O=3Mg(OH)2+2NH3.上世纪60年代就有人将气体D作为燃料电池的燃料源进行了试验,制成D-空气燃料电池系统,总反应式为:D+O2→A+H2O(未配平),写出此碱性燃料电池的负极反应式:2NH3+6OH--6e-=N2+6H2O.
(1)若条件①为点燃,目前60%的B都是从海水中提取的,气体D可以使湿润的红色石蕊试纸变蓝,写出C与H2O反应的化学方程式Mg3N2+6H2O=3Mg(OH)2+2NH3.上世纪60年代就有人将气体D作为燃料电池的燃料源进行了试验,制成D-空气燃料电池系统,总反应式为:D+O2→A+H2O(未配平),写出此碱性燃料电池的负极反应式:2NH3+6OH--6e-=N2+6H2O.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
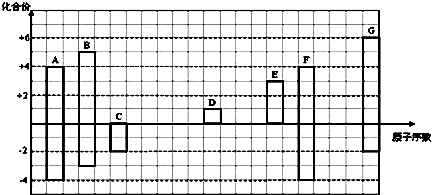
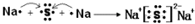 其所含化学键类型为离子键
其所含化学键类型为离子键 ,C与D形成的具有强氧化性的化合物的电子式为
,C与D形成的具有强氧化性的化合物的电子式为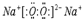

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有1种 | B. | 有2种 | C. | 有3种 | D. | 有4种 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com