
| A. | NaCl和HNO3 | B. | H2O和NH3 | C. | CaF2和MgCl2 | D. | CCl4和HCl |
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图是一套检验气体的实验装置示意图,向装置中缓慢通入气体X,若关闭活塞K,则品红溶液无变化而澄清石灰水变浑浊:若打开活塞K,则品红溶液褪色.根据此现象判断,X和Y可能是( )
如图是一套检验气体的实验装置示意图,向装置中缓慢通入气体X,若关闭活塞K,则品红溶液无变化而澄清石灰水变浑浊:若打开活塞K,则品红溶液褪色.根据此现象判断,X和Y可能是( )| A. | X:SO2,Y:饱和NaHCO3溶液 | B. | X:Cl2,Y:饱和Na2SO3溶液 | ||
| C. | X:HCl,Y:饱和NaHSO3溶液 | D. | X:CO2,Y:饱和Na2CO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 分析图,回答以下问题:
分析图,回答以下问题:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
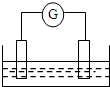 如图是常见原电池装置,电流表G发生偏转:
如图是常见原电池装置,电流表G发生偏转:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 与
与 
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com