
 分析图,回答以下问题:
分析图,回答以下问题:分析 (1)根据水电解生成H2,需要消耗大量电能得出答案;
(2)根据氢气的性质和燃烧的产物来回答;
(3)若电解质溶液为KOH溶液时,负极上氢气失电子和氢氧根离子反应生成水,正极上氧气得电子和水生成氢氧根离子.
解答 解:(1)水电解制取H2,需要消耗大量电能,所以首先要解决的问题是水电解制取H2,需要消耗大量电能,故答案为:水电解制取H2,需要消耗大量电能;
(2)氢气作为能源的三个主要优点①来源丰富;②单位质量的氢燃烧时释放的热量大,③产物对环境无污染;
故答案为:来源丰富;单位质量的氢燃烧时释放的热量大;
(3)若电解质溶液为KOH溶液时,正极上氧气得电子和水生成氢氧根离子,电极反应式为O2+4e-+2H2O=4OH-,负极上氢气失电子和氢氧根离子反应生成水,发生氧化反应,电极反应式为H2+2OH--2e-=2H2O,故答案为:负;氧化;O2+4e-+2H2O=4OH-;H2+2OH--2e-=2H2O.
点评 本题考查氢气的应用以及电极反应式的书写,为考试热点,注意电解质溶液酸碱性对电极反应式的影响,书写电极反应式一定要结合电解质溶液酸碱性,为易错点.


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:解答题

 ,温度高于150℃完全分解得到固体Y和固体Z的化学方程式为4Na2SO3$\frac{\underline{\;高温\;}}{\;}$3Na2SO4+Na2S;
,温度高于150℃完全分解得到固体Y和固体Z的化学方程式为4Na2SO3$\frac{\underline{\;高温\;}}{\;}$3Na2SO4+Na2S;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 与足量酸性高锰酸钾反应 | B. | 依次通入通入足量溴水和浓硫酸中 | ||
| C. | 在一定条件下通入H2 | D. | 分别进行燃烧 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
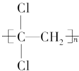 )具有超强阻隔性能,可作为保鲜食品的包装材料.它是由CCl2=CH2(写结构简式)发生加聚反应生成的.
)具有超强阻隔性能,可作为保鲜食品的包装材料.它是由CCl2=CH2(写结构简式)发生加聚反应生成的.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
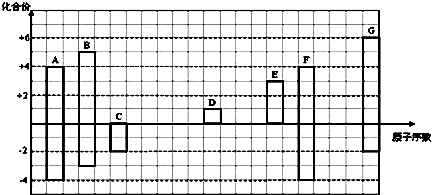
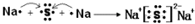 其所含化学键类型为离子键
其所含化学键类型为离子键 ,C与D形成的具有强氧化性的化合物的电子式为
,C与D形成的具有强氧化性的化合物的电子式为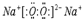

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 CH3COOCH2CH2CH3+H2O.
CH3COOCH2CH2CH3+H2O.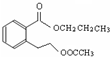 或
或 .
.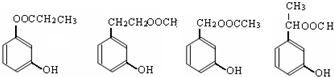 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com