
| A. |  | B. |  | C. | 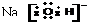 | D. |  |
分析 A、氯化钠为离子化合物;
B、CCl4是共价化合物,每个Cl原子与C原子之间形成一对共用电子对;
C、NaOH是离子化合物,在该化合物中存在离子键、极性共价键;
D、HClO是共价化合物,O原子分别与一个H、Cl原子重新一对共用电子对.
解答 解:A.NaCl是离子化合物,在阴阳离子之间存在离子键,电子式是: ,故A正确;
,故A正确;
B.CCl4是共价化合物,每个Cl原子与C原子之间形成一对共用电子对,电子式为 ,故B正确;
,故B正确;
C.NaOH是离子化合物,在该化合物中存在离子键、极性共价键,钠离子带一个单位正电荷,电子式为: ,故C错误;
,故C错误;
D.HClO是共价化合物,O原子分别与一个H、Cl原子重新一对共用电子对,达到每个原子的稳定结构,电子式为: ,故D正确,故选C.
,故D正确,故选C.
点评 本题主要考查的是电子式的书写与判断,判断物质属于离子化合物还是共价化合物是关键.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
 分析图,回答以下问题:
分析图,回答以下问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 第ⅤA族元素的原子R与A原子结合形成RA3气态分子,其立体结构呈三角锥形.RCl5在气态和液态时,分子结构如图所示,下列关于RCl5分子的说法中不正确的是( )
第ⅤA族元素的原子R与A原子结合形成RA3气态分子,其立体结构呈三角锥形.RCl5在气态和液态时,分子结构如图所示,下列关于RCl5分子的说法中不正确的是( )| A. | 分子中5个R-Cl键键能不都相同 | |
| B. | 键角(Cl-R-Cl)有90°、120、180°几种 | |
| C. | RCl5受热后会分解生成分子立体结构呈三角锥形的RCl3 | |
| D. | 每个原子都达到8电子稳定结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
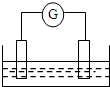 如图是常见原电池装置,电流表G发生偏转:
如图是常见原电池装置,电流表G发生偏转:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 以氮化镓(GaN)为代表的第三代半导体材料目前已成为全球半导体研究的前沿和热点.回答下列问题:
以氮化镓(GaN)为代表的第三代半导体材料目前已成为全球半导体研究的前沿和热点.回答下列问题: .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2-甲基-1-丁烯 | B. | 2-甲基-2-丁烯 | ||
| C. | 3-甲基-1-丁炔 | D. | 3,3-二甲基-1-丁炔 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 实验室用图示装置制取乙酸乙酯.
实验室用图示装置制取乙酸乙酯.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com