
【题目】石油产品中除含有H2S外,还含有各种形态的有机硫,如COS、CH3SH。回答下列问题:
(1)CH3SH(甲硫醇)的电子式为__。
(2)一种脱硫工艺为:真空K2CO3—克劳斯法。
①K2CO3溶液吸收H2S的反应为K2CO3+H2S=KHS+KHCO3,该反应的平衡常数的对数值为lgK=__(已知:H2CO3lgKa1=-6.4,lgKa2=-10.3;H2SlgKa1=-7,lgKa2=-19);
②已知下列热化学方程式:
a.2H2S(g)+3O2(g)=2SO2(g)+2H2O(l) △H1=-1172kJ·mol-1
b.2H2S(g)+O2(g)=2S(s)+2H2O(l) △H2=-632kJ·mol-1
克劳斯法回收硫的反应为SO2和H2S气体反应生成S(s),则该反应的热化学方程式为__。
(3)Dalleska等人研究发现在强酸溶液中可用H2O2氧化COS。该脱除反应的化学方程式为__。
(4)COS水解反应为COS(g)+H2O(g)![]() CO2(g)+H2S(g) △H=-35.5kJ·mol-1,用活性α—Al2O3催化,在其它条件相同时,改变反应温度,测得COS水解转化率如图1所示;某温度时,在恒容密闭容器中投入0.3molH2O(g)和0.1molCOS(g),COS的平衡转化率如图2所示。
CO2(g)+H2S(g) △H=-35.5kJ·mol-1,用活性α—Al2O3催化,在其它条件相同时,改变反应温度,测得COS水解转化率如图1所示;某温度时,在恒容密闭容器中投入0.3molH2O(g)和0.1molCOS(g),COS的平衡转化率如图2所示。
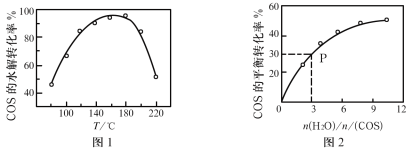
①活性α—Al2O3催化水解过程中,随温度升高COS转化率先增大后又减小的原因可能是__,为提高COS的转化率可采取的措施是__;
②由图2可知,P点时平衡常数K=__。
【答案】![]() 3.3 2H2S(g)+SO2(g)=3S(s)+2H2O(l) △H=-362kJ·mol-1 COS+4H2O2=CO2+H2SO4+3H2O 开始温度低,催化剂活性小,到160℃活化剂活性最大,继续升温,催化剂活性降低且平衡向逆反应方向移动 控制温度约160℃并增大
3.3 2H2S(g)+SO2(g)=3S(s)+2H2O(l) △H=-362kJ·mol-1 COS+4H2O2=CO2+H2SO4+3H2O 开始温度低,催化剂活性小,到160℃活化剂活性最大,继续升温,催化剂活性降低且平衡向逆反应方向移动 控制温度约160℃并增大![]() 0.0476
0.0476
【解析】
(1)CH3SH (甲硫醇)是共价化合物,硫原子形成两个共价键,碳原子形成四个共价键;
(2)①K2CO3溶液吸收H2S的反应为K2CO3+H2S=KHS+KHCO3,该反应的平衡常数![]() ;
;
②盖斯定律计算b×3-a得到克劳斯法回收硫的反应为SO2和H2S气体反应生成S(s)反应的热化学方程式;
(3)强酸溶液中可用H2O2氧化COS生成硫酸、二氧化碳和水;
(4)①图1活性α-Al2O3催化水解,催化剂与温度有一个临界点,高于这个临界点,催化剂活性降低;
②结合三行计算列式计算,P点时COS转化率30%,计算得到平衡物质的量,反应前后气体物质的量不变,可以用物质的量代替平衡浓度计算平衡常数。
(1)CH3SH (甲硫醇)是共价化合物,硫原子形成两个共价键,碳原子形成四个共价键,电子式为: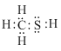 ,故答案为:
,故答案为: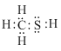 ;
;
(2)①K2CO3溶液吸收H2S的反应为K2CO3+H2S=KHS+KHCO3,该反应的平衡常数![]() ,lgK=LgKa1(H2S)-lgKa2(H2CO3)=-7-(-10.3)=3.3,
,lgK=LgKa1(H2S)-lgKa2(H2CO3)=-7-(-10.3)=3.3,
故答案为:3.3;
②已知下列热化学方程式:
a.2H2S(g)+3O2(g)═2SO2(g)+2H2O(l)△H1=-1172KJ/mol
b.2H2S(g)+O2(g)═2S(s)+2H2O(l)△H2=-632 KJ/mol
盖斯定律计算![]() 得到克劳斯法回收硫的反应为SO2和H2S气体反应生成S(s)反应的热化学方程式:2H2S(g)+SO2(g)=3S(s)+2H2O(l)△H=-362kJ·mol-1,故答案为:2H2S(g)+SO2(g)=3S(s)+2H2O(l)△H=-362kJ·mol-1;
得到克劳斯法回收硫的反应为SO2和H2S气体反应生成S(s)反应的热化学方程式:2H2S(g)+SO2(g)=3S(s)+2H2O(l)△H=-362kJ·mol-1,故答案为:2H2S(g)+SO2(g)=3S(s)+2H2O(l)△H=-362kJ·mol-1;
(3)Dalleska 等人研究发现在强酸溶液中可用H2O2氧化COS,该脱除反应的化学方程式为COS+4H2O2=CO2+H2SO4+3H2O,故答案为:COS+4H2O2=CO2+H2SO4+3H2O;
(4)①图1活性α-Al2O3催化水解,催化剂与温度有一个临界点,高于这个临界点,催化剂活性降低,由图可知:开始温度低,催化剂活性小,到160℃活化剂活性最大,继续升温,催化剂活性降低且平衡向逆反应方向移动;COS 水解反应为COS(g)+H2O(g)CO2(g)+H2S(g)△H=-35.5 KJ/mol,平衡正向进行结合影响平衡因素温度、压强、浓度分析可知,压强改变不影响化学平衡,所以增加水蒸气的浓度,升温平衡逆向进行,COS转化率减小,到160℃活化剂活性最大所以需要控制温度160°C,故答案为:开始温度低,催化剂活性小,到160℃活化剂活性最大,继续升温,催化剂活性降低且平衡向逆反应方向移动;控制温度约160℃并增大![]() ;
;
②P点时COS转化率30%,反应前后气体物质的量不变,可以用物质的量代替平衡浓度计算平衡常数,

平衡常数![]() ,故答案为:0.0476。
,故答案为:0.0476。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】图乙是根据图甲的电解池进行电解时某个量(纵坐标x)随时间变化的函数曲线(各电解池都用石墨作电极,不考虑电解过程中溶液浓度变化对电极反应的影响),这个量x是表示( )
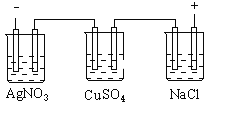
甲 乙
A. 各电池析出气体体积总数的变化B. 各电解池阳极质量的增加
C. 各电解池阴极质量的增加D. 各电极上放电的离子总数的变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,将浓度均为0.1 mol·L-1,体积分别为Va和Vb的HA溶液与BOH溶液按不同体积比混合,保持Va+Vb=100 mL,Va、Vb与混合液pH的关系如图所示,下列说法正确的是

A. Ka(HA)=1×10-6
B. b点c(B+)=c(A-)=c(OH-)=c(H+)
C. a→c过程中水的电离程度始终增大
D. c点时,c(A-)/[c(OH-)c(HA)]随温度升高而减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是重要的化工原料,具有广泛的开发和应用前景。在体积可变的密闭容器中投入0.5molCO和1molH2,不同条件下发生反应:CO(g)+2H2(g)![]() CH3OH(g)。实验测得平衡时CH3OH的物质的量随温度、压强的变化如图1所示。下列说法正确的是
CH3OH(g)。实验测得平衡时CH3OH的物质的量随温度、压强的变化如图1所示。下列说法正确的是
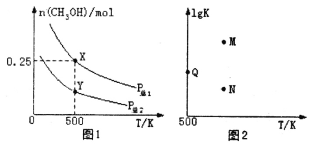
A.P总1<P总2
B.混合气体的密度不再发生变化,说明该反应已达到平衡状态
C.图2中M点能正确表示该反应平衡常数的对数(1gK)与温度的关系
D.若P总1=0.25MPa,则Y点的平衡常数Kp=64(MPa)-2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四种短周期元素在周期表中的位置如图,其中只有M为金属元素下列说法不正确的是( )
![]()
A. Y的最高价氧化物对应水化物的酸性比X的弱
B. Z位于元素周期表中第二周期,第ⅥA族
C. X的气态氢化物的稳定性比Z的弱
D. M的原子半径比Y的原子半径大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是现行中学化学教科书中元素周期表的一部分,除标出的元素外,表中的每个编号表示一种元素,请根据要求回答问题:
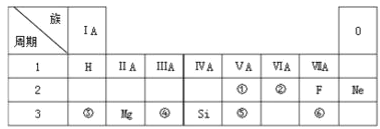
(1)②表示的元素是 ______ (填元素符号)。
(2)①与⑤两种元素相比较,原子半径较大的是______ (填元素符号),其非金属性较强的是 ______ (填元素符号),其最高正价氧化物水化物酸性较强的酸是 ______ (填分子式)。
(3)⑥元素的单质可以用来制取漂白粉,其有效成分是______(填化学式)。
(4)②与⑥元素的氢化物的稳定性:______大于______(填分子式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】改变0.1mol·L-1二元弱酸H2A溶液的pH,溶液中H2A、HA-、A2-的物质的量分数δ(X)随pH的变化如图所示[已知δ(X)=![]() ]。下列叙述错误的是( )
]。下列叙述错误的是( )
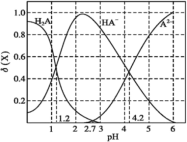
A.pH=1.2时,c(H2A)=c(HA-)
B.pH=2.7时,c(HA-)>c(H2A)=c(A2-)
C.pH=4.2时,c(HA-)=c(A2-)=c(H+)
D.lg[K2(H2A)]=-4.2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列装置或实验操作正确的是

A. ①用pH试纸测某溶液的酸碱性 B. ②探究氧化性:KMnO4>Cl2>I2
C. ③吸收氨气制氨水 D. ④中和滴定实验
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,在一刚性容器内部有一个不漏气且可以滑动的活塞,将容器分割成左右两室。左室充入N2,右室充入H2和O2,活塞正好使N2占容器体积的![]() (如图)。
(如图)。
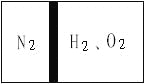
然后点燃H2和O2的混合气体,反应完毕后恢复至原来的温度,活塞正好停留在容器的中间。经检验,此时右室中气体可使带火星的木条复燃。则反应前H2和O2的物质的量之比为___。(请简要写出计算过程)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com