
【题目】某同学为了探究沉淀的溶解平衡原理并测定某温度下PbI2的溶度积常数,设计了如下实验:I、取100mL蒸馏水,加入过量的PbI2固体(黄色),搅拌、静置,过滤到洁净的烧杯中,得到滤液a ;II、取少量滤液a于试管中,向其中加入几滴0.1mol/L的KI溶液,观察现象 ; III、另准确量取10.00 mL滤液,与离子交换树脂(RH)发生反应:2RH+Pb2+=R2Pb+2H+,交换完成后,流出液用中和滴定法测得n (H+)=3.000×10—5mol。分析过程,下列说法错误的是
A.步骤I中搅拌的目的是使碘化铅充分溶解
B.步骤II中观察到的现象是产生黄色沉淀
C.此实验温度下,PbI2的溶度积常数Ksp=1.350×10-8
D.若步骤I 盛装滤液的烧杯中有少量的水,Ksp的测定结果不受影响
【答案】D
【解析】
A.步骤I中搅拌的目的是使为了加速固体碘化铅的溶解速率,使物质充分溶解,选项A正确;
B.根据步骤I可知滤液是碘化铅的饱和溶液。在溶液中存在沉淀溶解平衡:PbI2(s)![]() Pb2+(aq) +2I-(aq)。当向该溶液中加入几滴0.1mol/L的KI溶液时,c(I-)增大,c(Pb2+)c2(I-)>Ksp[PbI2(s)],沉淀溶解平衡向逆向移动,所以在步骤II中会观察到产生黄色沉淀,选项B正确;
Pb2+(aq) +2I-(aq)。当向该溶液中加入几滴0.1mol/L的KI溶液时,c(I-)增大,c(Pb2+)c2(I-)>Ksp[PbI2(s)],沉淀溶解平衡向逆向移动,所以在步骤II中会观察到产生黄色沉淀,选项B正确;
C.根据步骤III中反应方程式2RH+Pb2+=R2Pb+2H+,可知n(Pb2+)=" n" (H+)/2=1.500×10—5mol。则n(I-)=2 n(Pb2+)=3.000×10—5mol。c(Pb2+)=1.500×10—5mol÷0.0100 L=1.500×10—3mol/L;c(I-)=![]() =3.000×10—3mol/L。所以此实验温度下,PbI2的溶度积常数Ksp=c(Pb2+)c2(I-)=1.500×10—3mol/L×(3.000×10—3mol/L)=1.350×10-8 mol3/L3,选项C正确;
=3.000×10—3mol/L。所以此实验温度下,PbI2的溶度积常数Ksp=c(Pb2+)c2(I-)=1.500×10—3mol/L×(3.000×10—3mol/L)=1.350×10-8 mol3/L3,选项C正确;
D.沉淀溶解平衡常数只与温度有关,而与其它外界条件无关。所以若步骤I 盛装滤液的烧杯中有少量的水,使c(Pb2+)、c(I-)>减小,所以Ksp的测定结果就必然偏小,选项D错误。
答案选D。


科目:高中化学 来源: 题型:
【题目】对某溶液中部分离子的定性检测流程如下。相关分析正确的是

A. 步骤①所加试剂可以是浓NaOH溶液
B. 可以用湿润的蓝色石蕊试纸检验生成的无色气体
C. 红褐色沉淀与HI反应的离子方程式为:Fe(OH)3+3H+=Fe3++3H2O
D. 步骤②的反应为:Al3++3HCO3-=Al(OH)3↓+CO2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,向20mL0.1 mol/L H2R溶液中滴加0.1 mol/LNaOH溶液,溶液的pH随NaOH溶液体积的变化如图所示。已知pKa=﹣lgKa,二元弱酸H2R的pKa1=1.89,pKa2=7.21。下列有关说法错误的是

A. 溶液的导电性:点a弱于点b
B. 离子浓度c(R2-):点c小于点d
C. H2R + R2-=2HR-平衡常数>105,反应趋于完全
D. 点b时,y<7且![]() <1
<1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.常温下将0.1 mol NH4Cl和0.02 mol NaOH溶于水配成1 L溶液。
(1)该溶液中存在的平衡体系有(用离子方程式表示)________
(2)此溶液中共有________ 种离子。
(3)这些离子中浓度为0.1mol/L的是___,浓度为0.02mol/L的离子是___。
(4)____和_____两种微粒的物质的量之和比OH-的物质的量多0.08 mol。
II.(5)在粗制CuSO4·5H2O晶体中常含有杂质Fe2+。
①在提纯时为了除去Fe2+,常加入合适氧化剂,使Fe2+氧化为Fe3+,下列物质中最适宜采用的是________(填选项字母)
A.KMnO4 B.H2O2 C.氯水 D.HNO3
②然后再加入适当物质调整溶液至pH=4,使Fe3+转化为Fe(OH)3,调整溶液pH可选用下列物质中的______(填选项字母)
A.NaOH B.NH3·H2O C.CuO D.Cu(OH)2
(6)在t℃时,某NaOH稀溶液中,c(H+)=10-a mol/L,c(OH-)=10-b mol/L,已知a+b=12,则:该温度下水的离子积常数Kw=________,在该温度下,将100 mL 0.1 mol/L的稀硫酸与100 mL 0.4 mol/L的NaOH溶液混合后,溶液的pH=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量纯净的氨基甲酸铵置于密闭真空恒容容器中(固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s)![]() 2NH3(g)+CO2(g) △H = + a kJ·mol-l。能判断该分解反应已经达到化学平衡的是( )
2NH3(g)+CO2(g) △H = + a kJ·mol-l。能判断该分解反应已经达到化学平衡的是( )
A. v(NH3)=2v(CO2) B. 密闭容器中NH3体积分数不变
C. 反应吸收a kJ热量 D. 密闭容器中混合气体的密度不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温度为T℃时,向V L的密闭容器中充入一定量的A和B,发生的反应为A(g)+B(g)![]() C(s)+xD(g) ΔH>0,容器中A、B、D的物质的量浓度随时间的变化如表所示。下列说法不正确的是( )
C(s)+xD(g) ΔH>0,容器中A、B、D的物质的量浓度随时间的变化如表所示。下列说法不正确的是( )
时间 | 0 | 5 min | 10 min | 15 min | 20 min | 25 min | 30 min |
A的物质的量浓度(mol·L-1) | 3.5 | 2.3 | 2.0 | 2.0 | 2.8 | 3.0 | 3.0 |
B的物质的量浓度(mol·L-1) | 2.5 | 1.3 | 1.0 | 1.0 | 1.8 | 2.0 | 2.0 |
D的物质的量浓度(mol·L-1) | 0 | 2.4 | 3.0 | 3.0 | 1.4 | 1.0 | 1.0 |
A.前10 min的平均反应速率v(D)=0.3 mol·L-1·min-1
B.该反应的平衡常数表达式为K=![]()
C.若达到平衡时保持温度不变,压缩容器体积,平衡不移动
D.反应至15 min时,改变的条件可以是降低温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(2018·安徽省合肥市高三第三次教学质量检测)H2S在重金属离子处理、煤化工等领域都有重要应用。请回答:
Ⅰ.H2S是煤化工原料气脱硫过程的重要中间体,反应原理为
ⅰ.COS(g)+H2(g)![]() H2S(g)+CO(g)△H=+7kJ·mol1
H2S(g)+CO(g)△H=+7kJ·mol1
ⅱ.CO(g)+H2O(g)![]() CO2(g)+H2(g)△H=42kJ·mol1
CO2(g)+H2(g)△H=42kJ·mol1
已知断裂1mol气态分子中的化学键所需能量如下表所示。
分子 | COS(g) | H2(g) | CO(g) | H2S(g) |
能量(kJ·mol1) | 1310 | 442 | x | 669 |
(1)计算表中x=_______。
(2)T℃时,向VL容积不变的密闭容器中充入1mol COS(g)、1mol H2(g)和1mol H2O(g),发生上述两个反应。
①在T℃时测得平衡体系中COS为0.80 mol,H2为0.85 mol,则T℃时反应ⅰ的平衡常数K=_______(保留2位有效数字)。
②上述反应达平衡后,若向其中再充入1mol COS(g)、1molH2(g)和1mol H2O(g),则再次达平衡后H2的体积分数_______(填“增大”、“减小”或“不变”);若升高温度,则CO的平衡体积分数_______(填“增大”、“减小”或“不变”),其理由是_______。
Ⅱ.H2S在高温下分解制取H2,同时生成硫蒸气。
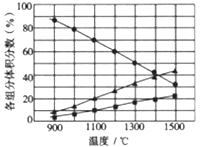
(3)向2L密闭容器中加入0.2molH2S,反应在不同温度(900~1500℃)下达到平衡时,混合气体中各组分的体积分数如下图所示,则在此温度区间内,H2S分解反应的主要化学方程式为_______;在1300℃时,反应经2min达到平衡,则0~2min的反应速率v(H2S)=_______。
Ⅲ.H2S用作重金属离子的沉淀剂。
(4)25℃时,向浓度均为0.001mol·L1Sn2+和Ag+的混合溶液中通入H2S,当Sn2+开始沉淀时,溶液中c(Ag+)=_______。(已知:25℃时,Ksp(SnS)=1.0×1025,Ksp(Ag2S)=1.6×1049)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用惰性电极电解一定浓度的 CuSO4 溶液一段时间后,欲使溶液恰好恢复至电解前情况,需加入的物质是
A. CuSO4 B. Cu C. CuCO3 D. Cu2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】12.0g某液态有机化合物A完全燃烧后,生成14.4g H2O和26.4g CO2。测得有机化合物A的蒸气对H2的相对密度是30,求:
(1)有机物A的分子式_______________________。(写出计算过程)
(2)用如图所示装置测定有机物A的分子结构,实验数据如下(实验数据均已换算为标准状况):a mL(密度为ρ g/cm3)的有机物A与足量钠完全反应后,量筒液面读数为b mL,若1mol A分子中有x mol氢原子能跟金属钠反应,则x的计算式为____________(可以不化简,写出计算过程)。

(3)已知该有机物能够与金属钠或钾发生反应,并对有机物进行核磁共振操作,发现核磁共振氢谱图上有三组吸收峰,且峰面积之比为6:1:1,请写出该物质的结构简式:_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com