
ЎҫМвДҝЎҝҝЙДж·ҙУҰўЩX(g)+2Y(g)![]() 2Z(g)ЎўўЪ2M(g)
2Z(g)ЎўўЪ2M(g) ![]() Ng)+P(g)·ЦұрФЪГЬұХИЭЖчөДБҪёц·ҙУҰКТЦРҪшРРЈ¬·ҙУҰКТЦ®јдУРОЮДҰІБЎўҝЙ»¬¶ҜөДГЬ·вёф°еЎЈ·ҙУҰҝӘКјәНҙпөҪЖҪәвЧҙМ¬КұУР№ШОпАнБҝөДұд»ҜИзНјЛщКҫЈ¬ПВБРЕР¶ПІ»ХэИ·өДКЗ
Ng)+P(g)·ЦұрФЪГЬұХИЭЖчөДБҪёц·ҙУҰКТЦРҪшРРЈ¬·ҙУҰКТЦ®јдУРОЮДҰІБЎўҝЙ»¬¶ҜөДГЬ·вёф°еЎЈ·ҙУҰҝӘКјәНҙпөҪЖҪәвЧҙМ¬КұУР№ШОпАнБҝөДұд»ҜИзНјЛщКҫЈ¬ПВБРЕР¶ПІ»ХэИ·өДКЗ
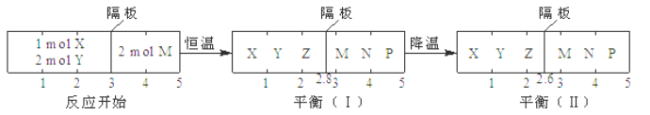
A. ·ҙУҰўЩөДХэ·ҙУҰКЗ·ЕИИ·ҙУҰ
B. ҙпЖҪәв(I)КұМеПөөДС№ЗҝУл·ҙУҰҝӘКјКұМеПөөДС№ЗҝЦ®ұИОӘ10:11
C. ҙпЖҪәв(I)КұЈ¬XөДЧӘ»ҜВКОӘ20ЈҘ
D. ФЪЖҪәв(I)әНЖҪәв(II)ЦРЈ¬MөДМе»э·ЦКэІ»ПаөИ
Ўҫҙр°ёЎҝC
ЎҫҪвОцЎҝ
AЎўҪөОВУЙЖҪәвЈЁўсЈ©ПтЖҪәвЈЁўтЈ©ТЖ¶ҜЈ¬Н¬КұXЎўYЎўZөДЧЬОпЦКөДБҝјхЙЩЈ¬ЛөГчЖҪәвПтУТТЖ¶ҜЈ¬Хэ·ҙУҰ·ЕИИЈ¬Дж·ҙУҰОӘОьИИ·ҙУҰЈ¬№КAХэИ·Ј»
BЎўЖҪәвКұЈ¬УТұЯОпЦКөДБҝІ»ұдЈ¬УЙНјҝЙТФҝҙіцҙпЖҪәвЈЁўсЈ©КұМеПөөДС№ЗҝУл·ҙУҰҝӘКјКұМеПөөДС№ЗҝЦ®ұИОӘЈә![]()
![]() Ј¬№КBХэИ·Ј»
Ј¬№КBХэИ·Ј»
CЎўҙпЖҪәвЈЁўсЈ©КұЈ¬УТұЯЖшМеөДОпЦКөДБҝІ»ұдЈ¬ИФОӘ2molЈ¬ЧуУТЖшМеС№ЗҝПаөИЈ¬ЙиЖҪәвКұЧуұЯЖшМеөДОпЦКөДБҝОӘxmolЈ¬ФтУРЈә![]() Ј¬x=
Ј¬x=![]() molЈ¬јҙОпЦКөДБҝјхЙЩБЛ(3-
molЈ¬јҙОпЦКөДБҝјхЙЩБЛ(3-![]() )mol=
)mol=![]() molЈ¬ЛщТФҙпЖҪәвЈЁўсЈ©КұЈ¬XөДЧӘ»ҜВКОӘ
molЈ¬ЛщТФҙпЖҪәвЈЁўсЈ©КұЈ¬XөДЧӘ»ҜВКОӘ![]() Ј¬ №КCҙнОуЈ»
Ј¬ №КCҙнОуЈ»
DЎўУЙЖҪәвЈЁўсЈ©өҪЖҪәвЈЁўтЈ©Ј¬»ҜС§·ҙУҰўЪ·ўЙъЖҪәвөДТЖ¶ҜЈ¬ФтMөДМе»э·ЦКэІ»ПаөИЈ¬№КDХэИ·Ј»
ҙр°ёСЎCЎЈ



| Дкј¶ | ёЯЦРҝОіМ | Дкј¶ | іхЦРҝОіМ |
| ёЯТ» | ёЯТ»Гв·СҝОіМНЖјцЈЎ | іхТ» | іхТ»Гв·СҝОіМНЖјцЈЎ |
| ёЯ¶ю | ёЯ¶юГв·СҝОіМНЖјцЈЎ | іх¶ю | іх¶юГв·СҝОіМНЖјцЈЎ |
| ёЯИэ | ёЯИэГв·СҝОіМНЖјцЈЎ | іхИэ | іхИэГв·СҝОіМНЖјцЈЎ |
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝөӘЎўБтЎўВИј°Жд»ҜәПОпКЗЦРС§»ҜС§ЦШТӘөДЧйіЙІҝ·ЦЎЈ
ЈЁ1Ј©°ұЖшИјБПөзіШК№УГөДөзҪвЦКИЬТәКЗKOHИЬТәЈ¬өзіШ·ҙУҰОӘЈә4NH3+3O2ЈҪ2N2+6H2OЎЈёГөзіШёәј«өДөзј«·ҙУҰКҪОӘ__________Ј»УГёГөзіШҪшРРҙЦНӯЈЁә¬AlЎўZnЎўAgЎўPtЎўAuөИФУЦКЈ©өДөзҪвҫ«Б¶Ј¬ТФCuSO4ИЬТәОӘөзҪвЦКИЬТәЈ¬ПВБРЛө·ЁХэИ·өДКЗ________ЎЈ
aЈ®өзДЬИ«ІҝЧӘ»ҜОӘ»ҜС§ДЬ
bЈ®SO42©ҒөДОпЦКөДБҝЕЁ¶ИІ»ұдЈЁІ»ҝјВЗИЬТәМе»эұд»ҜЈ©
cЈ®ИЬТәЦРCu2+ПтСфј«ТЖ¶Ҝ
dЈ®АыУГСфј«ДаҝЙ»ШКХAgЎўPtЎўAuөИҪрКф
eЈ®ИфСфј«ЦКБҝјхЙЩ64gЈ¬ФтЧӘТЖөзЧУКэОӘ2NAёц
ЈЁ2Ј©ўЩҪ«SO2НЁИлөҪBaCl2ИЬТәЦРЈ¬іцПЦБЛТміЈПЦПуЈ¬ҝҙөҪБЛГчПФөД°ЧЙ«іБөнЈ¬ОӘМҪҫҝёГ°ЧЙ«іБөнөДіЙ·ЦЈ¬ЛыЙијЖБЛИзПВКөСйБчіМЈәЛщөГРьЧЗТә![]() °ЧЙ«іБөн
°ЧЙ«іБөн![]() №ЫІмПЦПуІўЕР¶ПЈ¬ФтКФјБAөД»ҜС§КҪОӘ_________ЎЈКөСйұнГчЈ¬јУИлКФјБAәуЈ¬°ЧЙ«іБөнОҙјыИЬҪвЈ¬ІъЙъёГ°ЧЙ«іБөнөДАлЧУ·ҪіМКҪКЗ________ЎЈ
№ЫІмПЦПуІўЕР¶ПЈ¬ФтКФјБAөД»ҜС§КҪОӘ_________ЎЈКөСйұнГчЈ¬јУИлКФјБAәуЈ¬°ЧЙ«іБөнОҙјыИЬҪвЈ¬ІъЙъёГ°ЧЙ«іБөнөДАлЧУ·ҪіМКҪКЗ________ЎЈ
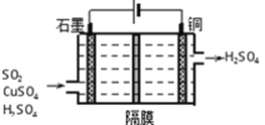
ўЪАыУГИзНјЛщКҫөз»ҜС§Ч°ЦГОьКХ№ӨТөОІЖшЦРSO2Ј¬Тхј«ЙПЙъіЙCuЎЈРҙіцЧ°ЦГЦРСфј«өДөзј«·ҙУҰКҪ_________ЎЈ
ЈЁ3Ј©ТСЦӘKspЈЁBaSO4Ј©=1.0ЎБ10©Ғ10Ј¬KspЈЁBaCO3Ј©=2.5ЎБ10-9ЎЈДіН¬С§ЙиПлУГПВБРБчіМөГөҪBaCl2Ј¬BaSO4![]() BaSO3
BaSO3![]() BaCl2ЎЈФтўЩөДАлЧУ·ҪіМКҪОӘ________Ј¬ёГ·ҙУҰөДЖҪәвіЈКэK=_________ЎЈ
BaCl2ЎЈФтўЩөДАлЧУ·ҪіМКҪОӘ________Ј¬ёГ·ҙУҰөДЖҪәвіЈКэK=_________ЎЈ
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝОӘұИҪПFe3+әНCu2+¶ФH2O2·ЦҪв·ҙУҰөДҙЯ»ҜР§№ыЈ¬БҪО»Н¬С§·ЦұрЙијЖБЛИзНјјЧЎўТТЛщКҫөДКөСйЎЈПВБРРрКцІ»ХэИ·өДКЗЈЁ Ј©
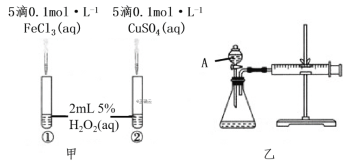
A.НјјЧЛщКҫКөСйҝЙНЁ№э№ЫІмІъЙъЖшЕЭөДҝмВэАҙұИҪП·ҙУҰЛЩВКөДҙуРЎ
B.ИфНјјЧЛщКҫКөСйЦР·ҙУҰЛЩВКОӘўЩ>ўЪЈ¬ФтЛөГчFe3+Т»¶ЁұИCu2+¶ФH2O2·ЦҪвөДҙЯ»ҜР§№ыәГ
C.УГНјТТЛщКҫЧ°ЦГІв¶Ё·ҙУҰЛЩВКЈ¬ҝЙІв¶Ё·ҙУҰІъЙъөДЖшМеМе»эј°·ҙУҰКұјд
D.ОӘјмІйНјТТЛщКҫЧ°ЦГөДЖшГЬРФЈ¬ҝЙ№ШұХAҙҰ»оИыЈ¬Ҫ«ЧўЙдЖч»оИыАӯіцТ»¶ЁҫаАлЈ¬Т»¶ОКұјдәуЛЙҝӘ»оИыЈ¬№ЫІм»оИыКЗ·с»ШөҪФӯО»
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝПВБРУР№ШКөСйөДЛө·ЁІ»ХэИ·өДКЗ
A. УГИзНјөзЧУМмЖҪіЖБҝ№ММеЈ¬¶БКэКұІаГЕУҰ№ШұХ

B. УГНРЕММмЖҪіЖИЎ10.2 g NaOH№ММеКұЈ¬Ҫ«10gөДнАВл·ЕФЪУТЕМЈ¬Ҫ«УОВлТЖөҪ0.2gөДО»ЦГ
C. ·Ц№в№в¶ИјЖҝЙУГУЪ·ЦОцИЬТәСХЙ«Ул·ҙУҰОп(ЙъіЙОп)ЕЁ¶ИөД№ШПөЈ¬ҙУ¶шИ·¶Ё»ҜС§·ҙУҰЛЩВК
D. ОьИлВИЖшЎўВИ»ҜЗвЖшМеКұЈ¬ҝЙОьИлЙЩБҝҫЖҫ«»тТТГСөД»мәПХфЖшҪв¶ҫ
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝПВБРёчРФЦКЦР·ыәПНјКҫ№ШПөөДКЗ
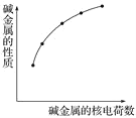
ўЩ»ҜәПјЫЎЎўЪROHөДјоРФЎЎўЫГЬ¶ИЎЎўЬЧоНвІгөзЧУКэЎЎўЭәЛНвөзЧУІгКэЎЎўЮөҘЦКК§eЈӯДЬБҰ
A.ўЪўЬўЭўЮB.ўЪўЭўЮC.ўЪўЫўЭўЮD.ўЩўЪўЫўЭ
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝЗлҪ«·ыәПМвТвөДПВБРұд»ҜөДРтәЕМоФЪ¶ФУҰөДәбПЯЙПЈәўЩөвөДЙэ»ӘЈ»ўЪСхЖшИЬУЪЛ®Ј»ўЫВИ»ҜДЖИЬУЪЛ®Ј»ўЬЙХјоИЫ»ҜЈ»ўЭВИ»ҜЗвИЬУЪЛ®Ј»ўЮВИ»Ҝп§КЬИИ·ЦҪвЎЈ
ЈЁ1Ј©»ҜС§јьГ»УРұ»ЖЖ»өөДКЗ__________Ј»Ҫц·ўЙъАлЧУјьЖЖ»өөДКЗ__________Ј»
ЈЁ2Ј©јҙ·ўЙъАлЧУјьЖЖ»өЎўУЦ·ўЙъ№ІјЫјьЖЖ»өөДКЗ____________________Ј»
ЈЁ3Ј©N2өДөзЧУКҪОӘ__________Ј»Na2O2өДөзЧУКҪОӘ___________Ј»CO2өДөзЧУКҪОӘ_________Ј»
ЈЁ4Ј©УГөзЧУКҪұнКҫMgCl2өДРОіЙ№эіМ _____________________Ј»
ЈЁ5Ј©ТСЦӘІрҝӘ1 mol HЎӘHјьЎў1 mol NЎФNЎў1 mol NЎӘHјь·ЦұрРиТӘОьКХөДДЬБҝОӘ436 kJЎў946 k JЎў391 k JЎЈФтУЙN2әНH2·ҙУҰЙъіЙ1 mol NH3 РиТӘ·Еіц_____өДИИБҝЎЈ
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝПВБРУР№Ш»ҜС§·ҙУҰУлДЬБҝұд»ҜөДЛө·ЁХэИ·өДКЗ
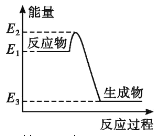
A. ИзНјЛщКҫөД»ҜС§·ҙУҰЦРЈ¬·ҙУҰОпөДјьДЬЦ®әНҙуУЪЙъіЙОпөДјьДЬЦ®әН
B. ПаН¬МхјюПВЈ¬ЗвЖшәНСхЖш·ҙУҰЙъіЙТәМ¬Л®ұИЙъіЙөИБҝөДЖшМ¬Л®·ЕіцөДИИБҝЙЩ
C. ҪрёХКҜФЪТ»¶ЁМхјюПВЧӘ»ҜіЙКҜД«ДЬБҝұд»ҜИзНјЛщКҫЈ¬ИИ·ҙУҰ·ҪіМКҪҝЙОӘ:C(sҪрёХКҜ) =C(sЈ¬КҜД«) HЈҪ-(E2ЎӘE3)kJЎӨmolЎӘ1
D. Н¬ОВН¬С№ПВЈ¬H2(g)+C12(g)==2HCl(g)ДЬБҝұд»ҜИзНјЛщКҫЈ¬ФЪ№вХХәНөгИјМхјюПВөДЎчHПаН¬
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝ№ӨТөҙЯ»ҜјБ K3[Fe(C2O4)3]ЎӨ3H2OКЗҙдВМЙ«ҫ§МеЈ¬ФЪ421Ў«553ЎжКұЈ¬·ЦҪвОӘFe2O3ЎўK2CO3ЎўCOЎўCO2ЎўH2OЎЈКөСйКТУЙІЭЛбСЗМъҫ§Ме(FeC2O4ЎӨH2O)ЎўІЭЛбјШ(K2C2O4)ЎўІЭЛб(H2C2O4)әНЛ«СхЛ®(H2O2)»мәПЦЖұёЎЈЗл»ШҙрПВБРОКМв
ЈЁ1Ј©РҙіцH2O2өДөзЧУКҪ:____________________
ЈЁ2Ј©ЕдЖҪёГ·ҪіМКҪ____FeC2O4ЎӨH2O+___H2O+ __K2 C2O4+__H 2C2O4=__K3[Fe(C2O4)3]ЎӨ3H2O
ЈЁ3Ј©ЦЖұё№эіМЦРТӘ·АЦ№ІЭЛбұ»H2O2Сх»ҜЈ¬ЗлРҙіцІЭЛбұ»H2O2Сх»ҜөД»ҜС§·ҙУҰ·ҪіМКҪ______Ј»
ЈЁ4Ј©ЕдәПОпөДОИ¶ЁРФҝЙТФУГОИ¶ЁіЈКэKАҙәвБҝЈ¬ИзCu2++4NH3ЈҪ[Cu(NH3)4]2+Ј¬ЖдОИ¶ЁіЈКэұнҙпКҪОӘ:![]() ЎЈТСЦӘK[Fe(C2O4)3]3ЎӘ=1020Ј¬ K[Fe(SCN)3]=2
ЎЈТСЦӘK[Fe(C2O4)3]3ЎӘ=1020Ј¬ K[Fe(SCN)3]=2![]() 103Ј¬ДЬ·сУГKSCNИЬТәјмСйK3[Fe(C2O4)3]ЎӨ3H2OЦРөДМъФӘЛШ?______(МоЎ°КЗЎұ»тЎ°·сЎұ)ИфСЎЎ°·сЎұЈ¬ЗлЙијЖјмСйМъФӘЛШөД·Ҫ°ё_________________________________________ЎЈ
103Ј¬ДЬ·сУГKSCNИЬТәјмСйK3[Fe(C2O4)3]ЎӨ3H2OЦРөДМъФӘЛШ?______(МоЎ°КЗЎұ»тЎ°·сЎұ)ИфСЎЎ°·сЎұЈ¬ЗлЙијЖјмСйМъФӘЛШөД·Ҫ°ё_________________________________________ЎЈ
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝ№ӨТөЙПАыУГH2әПіЙЗвөД·ҙУҰФӯАнОӘ:3H2(g)+N2(g) ![]() 2NH3(g)ЎЈПЦУРјЧЎўТТБҪёцИЭ»эОӘ1LөДГЬұХИЭЖч.ФЪПаН¬МхјюПВЈ¬°ҙІ»Н¬өД·ҙУҰОпН¶ИлБҝҪшРРәПіЙЗв·ҙУҰПа№ШКэҫЭИзПВұнКҫ:
2NH3(g)ЎЈПЦУРјЧЎўТТБҪёцИЭ»эОӘ1LөДГЬұХИЭЖч.ФЪПаН¬МхјюПВЈ¬°ҙІ»Н¬өД·ҙУҰОпН¶ИлБҝҪшРРәПіЙЗв·ҙУҰПа№ШКэҫЭИзПВұнКҫ:
ИЭЖч | јЧ | ТТ |
·ҙУҰОпН¶ИлБҝ | 2molH2Ўў2molN2 | 4malH2.4molN2 |
ЖҪәвКұN2өДЕЁ¶И(mol/L) | c1=1.5 | c2 |
NH3өДМе»э·ЦКэ | ҰШ1 | ҰШ2 |
»мәПЖшМеөДГЬ¶И(g/L) | ҰС1 | ҰС2 |
ЈЁ1Ј©ПВБРЗйҝцПВЈ¬·ҙУҰҙпөҪЖҪәвЧҙМ¬өДКЗ_____(МоРтәЕ)
AЎў3molH-H№ІјЫјь¶ПБСН¬КұУР6molN-H№ІјЫјьРОіЙ
BЎў3vХэ(N2)=vДж(H2)
CЎў»мәПЖшМеөДЖҪҫщПа¶Ф·ЦЧУЦКБҝұЈіЦІ»ұд
ЈЁ2Ј©·ҙУҰөДЖҪәвіЈКэK=_____________________(Ҫб№ыұЈБф3О»УРР§КэЧЦ).
ЈЁ3Ј©·ЦОцЙПұнЦРөДКэҫЭЈ¬УРТФПВ№ШПө:c2________3mol/LЈ»ҰШ1________ҰШ2(МоЎ°>ЎұЎўЎ°<ЎұЎўЎ°=Ўұ)Ј»
Ійҝҙҙр°ёәНҪвОц>>
№ъјКѧУУЕСЎ - Б·П°ІбБРұн - КФМвБРұн
әюұұКЎ»ҘБӘНшОҘ·ЁәНІ»БјРЕПўҫЩұЁЖҪМЁ | НшЙПУРәҰРЕПўҫЩұЁЧЁЗш | өзРЕХ©ЖӯҫЩұЁЧЁЗш | ЙжАъК·РйОЮЦчТеУРәҰРЕПўҫЩұЁЧЁЗш | ЙжЖуЗЦИЁҫЩұЁЧЁЗш
ОҘ·ЁәНІ»БјРЕПўҫЩұЁөз»°Јә027-86699610 ҫЩұЁУКПдЈә58377363@163.com