
【题目】下列有关新型无机非金属材料的说法中不正确的是( )
A.氧化铝陶瓷可用于制作假牙B.氧化铝陶瓷可用做半导体材料
C.氮化硅陶瓷可用于制陶瓷发动机D.光导纤维可用于能量传输、信息处理
 一课一练课时达标系列答案
一课一练课时达标系列答案科目:高中化学 来源: 题型:
【题目】用括号内的试剂和方法除去下列各物质中的少量杂质,不正确的是( )
A.苯中含有苯酚(浓溴水,过滤)
B.乙醇中的乙酸(CaO固体、蒸馏)
C.乙酸乙酯中含有乙酸(饱和Na2CO3溶液、分液)
D.乙烷中含有乙烯(溴水、洗气)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由下列实验及现象不能推出相应结论的是
选项 | 实验 | 现象 | 结论 |
A | 向添有KIO3的食盐中加入淀粉溶液、稀盐酸及KI | 溶液变蓝色 | 氧化性:IO |
B | 向稀氨水和酚酞混合溶液中加入少量Ag2O,振荡 | 溶液由浅红色变为红色 | Ag2O是强碱 |
C | 向装有经过硫酸处理的CrO3(桔红色)的硅胶导管中吹入乙醇蒸气 | 固体逐渐由桔红色变为浅绿色(Cr3+) | 乙醇具有还原性 |
D | 向盛有少量水的烧杯中加入少量Mg2Si | 产生白色沉淀,液面上有火苗 | Mg2Si水解生成Mg(OH)2和SiH4 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下列各图的叙述,正确的是
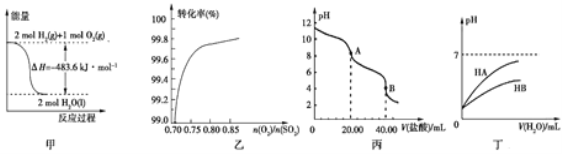
A. 图甲表示H2与O2发生反应过程中的能量变化,则H2的燃烧热为483.6 kJ·mol-1
B. 图乙表示反应2SO2(g)+O2(g)![]() 2SO3(g)在其他条件不变时,O2的转化率随
2SO3(g)在其他条件不变时,O2的转化率随![]() 的变化关系
的变化关系
C. 图丙表示用0.100 0 mol·L-1的盐酸滴定20.00 mL 0.100 0 mol·L-1Na2CO3溶液的曲线,从A点到B点反应的离子方程式为:CO32-+2H+![]() CO2↑+H2O
CO2↑+H2O
D. 图丁表示常温下,稀释HA、HB两种酸的稀溶液时,溶液的pH随加水量的变化,则同浓度溶液的pH:NaA<NaB
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2017年11月16日,国土资源部召开新闻发布会,宣布天然气水合物,即“可燃冰”新矿种获得国务院批准,成为我国第173个矿种。“可燃冰”主要成分的分子式是CH4·8H2O,一旦温度升高或压强降低,甲烷气就会逸出,固体水合物便趋于崩解。“可燃冰”将成为人类的后续能源。
(1)将320 g可燃冰释放的甲烷完全燃烧生成液态水时,可放出1 780.6 kJ的能量,则表示甲烷燃烧热的热化学方程式是__________________。
(2)CH4不仅是优质的气体燃料,还能利用它和CO2重整,发生反应:CO2(g)+CH4(g)![]() 2CO(g)+2H2(g),获得合成气(主要成分为CO、H2),从而减少温室气体的排放。在一定条件下CH4的平衡转化率与温度及压强(单位:Pa)的关系如图所示。则y点:v(正)____(填“>”、“=”或“<”,下同)v(逆);压强:p1____p2;该反应的ΔH____0。
2CO(g)+2H2(g),获得合成气(主要成分为CO、H2),从而减少温室气体的排放。在一定条件下CH4的平衡转化率与温度及压强(单位:Pa)的关系如图所示。则y点:v(正)____(填“>”、“=”或“<”,下同)v(逆);压强:p1____p2;该反应的ΔH____0。

(3)在恒温、p2下,在一容积可变的容器中,达到平衡状态x时四种气体的物质的量均为1 mol,若此时再充入四种气体各1 mol,则平衡____(填“向左”、“向右”或“不”)移动。
(4)一定条件下,CH4还可与NO2反应,改善雾霾天气,其化学方程式为CH4(g)+2NO2(g)![]() CO2(g)+2H2O(g)+N2(g),在恒温恒容下,下列可以判断该反应达到平衡状态的是____(填序号)。
CO2(g)+2H2O(g)+N2(g),在恒温恒容下,下列可以判断该反应达到平衡状态的是____(填序号)。
a.v逆(N2)=2v正(H2O)
b.混合气体的密度不再变化
c.混合气体的物质的量不再变化
d.单位时间内有1 mol NO2消耗同时消耗1 mol CO2
e.混合气体的平均相对分子质量不变
f.CH4与CO2的物质的量之比不再发生变化
(5)在恒温恒容下,使1 mol CH4(g)与2 mol NO2反应,达平衡后,再往反应器中分别充入下列气体,可以使CH4(g)+2NO2(g)![]() CO2(g)+2H2O(g)+N2(g)中NO2转化率增大的是____(填序号)。
CO2(g)+2H2O(g)+N2(g)中NO2转化率增大的是____(填序号)。
A.CH4 B.CO2
C.物质的量之比为1∶2的CH4与NO2 D.N2
(6)CH4还可以运用到电化学中,某课外小组用CH4为燃料,空气为氧化剂,稀土金属材料作电极,电浮选凝聚法处理污水,设计如图所示装置。则甲烷 燃料电池的总反应式为______。为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定,电池工作时必须有部分A物质参加循环(如图),A物质的化学式是______。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某铝合金中含有元素:铝、镁、铜、碳,为测定该合金中铝的含量。
Ⅰ 甲同学设计如下实验:
(1)称取样品a g(精确到0.1 g),溶于足量稀盐酸,过滤。
(2)向步骤(1)所得滤液中加入过量的氢氧化钠溶液,过滤并洗涤滤渣。有关反应的离子方程式是_________________________________、____________________________________________。
(3)向步骤(2)所得滤液中通入过量的二氧化碳气体,过滤并洗涤滤渣。有关反应的离子方程式是_________________________________、____________________________________________。
(4)将步骤(3)所得的滤渣烘干并灼烧至恒重、冷却后称量,其质量为b g。有关反应的化学方程式是_________________________________。原样品中铝的质量分数是__________。
Ⅱ 乙同学认为也可以向一定质量的样品中直接加足量氢氧化钠溶液充分反应后,将剩余固体过滤、洗涤、干燥后称量,即可计算该合金中铝的含量。有关反应的离子方程式是____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】艾司洛尔是预防和治疗手术期心动过速或高血压的一种药物,艾司洛尔的一种合成路线如下:
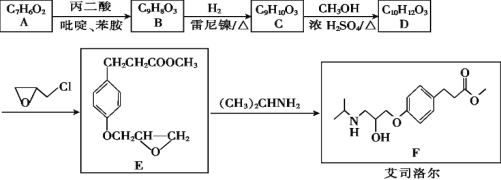
回答下列问题:
(1)丙二酸的结构简式为_______;E中含氧官能团的名称是_______。
(2)D生成E的反应类型为____________。
(3)C的结构简式为________________。
(4)A遇FeCl3溶液发生显色反应,1 mol A和1 mol丙二酸在吡啶、苯胺中反应生成1 mol B、1 mol H2O和1 mol CO2,B能与溴水发生加成反应,推测A生成B的化学方程式为____。
(5)X是B的同分异构体,X同时满足下列条件的结构共有____种,其中核磁共振氢谱有五组峰的结构简式为____。
①可与碳酸氢钠溶液反应生成二氧化碳
②遇FeCl3溶液发生显色反应
③除苯环外不含其他环
(6)写出以苯甲醇和丙二酸为原料制备![]() 的合成路线________(其他试剂任选)。
的合成路线________(其他试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,在一个2 L的密闭容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示。根据图中数据,试填写下列空白:
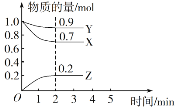
(1)该反应的化学方程式为_______________。
(2)反应开始至2 min,以气体Z表示的平均反应速率为________。
(3)可以判断上述反应已经达到平衡的是________。
A.v(A)∶v (B)∶v (C)等于化学计量数之比
B.密闭容器中总压强不变 C.密闭容器中混合气体的密度不变
D.混合气体的平均相对分子质量不再改变 E.n(A)∶n(B)∶n(C)等于化学计量数之比
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼镁泥是一种工业废料,主要成份是MgO(占40%,质量分数),还有CaO、MnO、Fe2O3、FeO、Al2O3、SiO2等杂质,以此为原料制取的硫酸镁,可用于印染、造纸、医药等工业。从硼镁泥中提取MgSO47H2O的工艺流程如下:
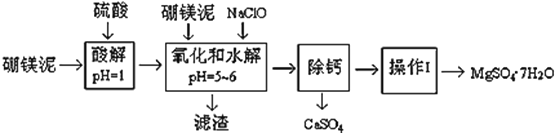
(1)实验中需要1 mol/L的硫酸800 mL,若用 98% 的浓硫酸(ρ= 1.84 g/mL)来配制,量取浓硫酸需要使用量筒的规格为__________(填写选项字母)
A.10 mL B.20 mL C.50 mL D.100 mL
(2)加入的NaClO可与Mn2+ 反应:Mn2+ + ClO + H2O = MnO2↓+ 2H+ + Cl ,在该步骤中还有一种离子也会被NaClO氧化,该反应的离子方程式为___________________。
(3)滤渣的主要成分除含有Fe(OH)3、Al(OH)3外,还含有__________,___________。
(4)在“除钙”前,需检验滤液中Fe3+ 是否被除尽,简述检验方法___________________。(写出操作、现象和结论)
(5)已知MgSO4、CaSO4 的溶解度(单位为 g/100 g 水)如下表:
温度(℃) | 40 | 50 | 60 | 70 |
MgSO4 | 30.9 | 33.4 | 35.6 | 36.9 |
CaSO4 | 0.210 | 0.207 | 0.201 | 0.193 |
“除钙”是将MgSO4和CaSO4混合溶液中的CaSO4除去,根据上表数据,简要说明操作步骤______。“操作Ⅰ”是将滤液继续蒸发浓缩,冷却结晶,______,便得到了MgSO47H2O
(6)实验中提供的硼镁泥共100 g,得到 MgSO47H2O为172.2 g ,则MgSO47H2O 的产率为___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com