
【题目】某铝合金中含有元素:铝、镁、铜、碳,为测定该合金中铝的含量。
Ⅰ 甲同学设计如下实验:
(1)称取样品a g(精确到0.1 g),溶于足量稀盐酸,过滤。
(2)向步骤(1)所得滤液中加入过量的氢氧化钠溶液,过滤并洗涤滤渣。有关反应的离子方程式是_________________________________、____________________________________________。
(3)向步骤(2)所得滤液中通入过量的二氧化碳气体,过滤并洗涤滤渣。有关反应的离子方程式是_________________________________、____________________________________________。
(4)将步骤(3)所得的滤渣烘干并灼烧至恒重、冷却后称量,其质量为b g。有关反应的化学方程式是_________________________________。原样品中铝的质量分数是__________。
Ⅱ 乙同学认为也可以向一定质量的样品中直接加足量氢氧化钠溶液充分反应后,将剩余固体过滤、洗涤、干燥后称量,即可计算该合金中铝的含量。有关反应的离子方程式是____________________________________________。
【答案】Mg2++2OH-===Mg(OH)2↓ Al3++4OH-===AlO2-+2H2O OH-+CO2===HCO3- AlO2-+CO2+2H2O===Al(OH)3↓+HCO3- 2Al(OH)3=△=Al2O3+3H2O 900b/17a% 2Al+2OH-+2H2O ===2AlO2-+3H2↑
【解析】
Ⅰ(2)将合金溶于足量稀盐酸,反应生成氯化镁和氯化铝,再加入过量氢氧化钠溶液,氯化镁与氢氧化钠反应生成氢氧化镁和氯化钠,反应的离子方程式为Mg2++2OH-=Mg(OH)2↓;氯化铝与足量的氢氧化钠反应生成偏铝酸钠、氯化钠和水,反应的离子方程式为Al3++4OH-=AlO2-+2H2O;
(3)向步骤(2)所得滤液中通入过量的二氧化碳气体,二氧化碳与氢氧化钠反应生成碳酸氢钠,反应的离子方程式为OH-+CO2=HCO3-;二氧化碳与偏铝酸钠反应生成氢氧化铝沉淀和碳酸氢钠,反应的离子方程式是AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;
(4)将步骤(3)所得的滤渣烘干并灼烧至恒重、冷却后称量,其质量为b g。有关反应的化学方程式是2Al(OH)3![]() Al2O3+3H2O;
Al2O3+3H2O;
所得b g固体为Al2O3,故合金中含Al的质量分数为![]() ×100%=
×100%=![]() %;
%;
Ⅱ 乙同学认为也可以向一定质量的样品中直接加足量氢氧化钠溶液充分反应后,将剩余固体过滤、洗涤、干燥后称量,铝与氢氧化钠溶液反应生成偏铝酸钠和氢气,反应的离子方程式是2Al+2OH-+2H2O =2AlO2-+3H2↑。


 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】钠熔融盐燃料电池拥有比锂电池高一倍的能量密度,在同等电池体积下,可让电动汽车行驶距离成倍提升。如图所示是某钠熔融盐燃料电池,其中生成物Y是一种氧化物。下列说法不正确的是

A. 电池工作时,石墨电极Ⅰ上电极反应式为2NO2 2e +O2![]() N2O5
N2O5
B. 电池工作时,![]() 向石墨电极Ⅰ移动
向石墨电极Ⅰ移动
C. 该电池充电时,石墨电极Ⅱ连接电源的负极
D. 电池工作时,外电路中流过1 mol电子,则消耗46 g NO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,向一定体积0.1 mol·L-1的醋酸溶液中逐滴加入等浓度的NaOH溶液,溶液中pOH[pOH=-lg c(OH-)]与pH的变化关系如图所示,则( )

A. M点所示溶液的导电能力强于Q点
B. N点所示溶液中c(CH3COO-)>c(Na+)
C. Q点pH一定等于7
D. Q点消耗NaOH溶液的体积等于醋酸溶液的体积
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱式碳酸铝镁[MgaAlb(OH)c(CO3)d·eH2O]在一定条件下的转化如下图所示,下列说法不正确的是

A. Q可能为NH3B. a、b、c、d符合关系式:2a+3b=c+2d
C. X可能为NaOHD. 碱式碳酸铝镁医疗上可用做抗酸剂,工业上可用做阻燃剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关新型无机非金属材料的说法中不正确的是( )
A.氧化铝陶瓷可用于制作假牙B.氧化铝陶瓷可用做半导体材料
C.氮化硅陶瓷可用于制陶瓷发动机D.光导纤维可用于能量传输、信息处理
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列表示物质结构的化学用语或模型正确的是
A. 苯分子的比例模型:
B. CO2的电子式:![]()
C. Cl-离子的结构示意图:
D. 乙烯的结构式:CH2=CH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.1molL﹣1的CH3COOH溶液滴定20mL 0.1molL﹣1的NaOH溶液,当滴加VmLCH3COOH溶液时,混合溶液的pH=7.已知CH3COOH的电离平衡常数为Ka,忽略混合时溶液体积的变化,下列关系式正确是( )
A.Ka=![]() B.V=
B.V=![]()
C.Ka=![]() D.Ka=
D.Ka=![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图装置研究电化学原理,下列分析中错误的是
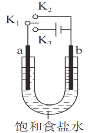
选项 | 连接 | 电极材料 | 分析 | |
a | b | |||
A | K1K2 | 石墨 | 铁 | 模拟铁的吸氧腐蚀 |
B | K1K2 | 锌 | 铁 | 模拟钢铁防护中牺牲阳极的阴极保护法 |
C | K1K3 | 石墨 | 铁 | 模拟电解饱和食盐水 |
D | K1K3 | 铁 | 石墨 | 模拟钢铁防护中外加电流的阴极保护法 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组的同学利用下图所示实验装置进行实验(图中a、b、c表示止水夹)
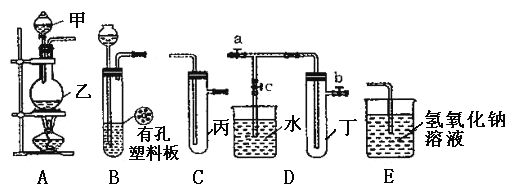
(1)甲、乙两仪器的名称是 ____________ 、_______________。
(2)A、C、E相连后的装置可用于制取Cl2,写出A中发生反应的化学方程式 _____________。
(3)B、D、E装置相连后,在B中盛装浓硝酸和铜片(铜片放在有孔塑料板上)可制得NO2并进行有关实验。
①欲用D装置验证NO2与水的反应,其操作步骤为:先关闭止水夹____________,再打开止水夹 ______,使烧杯中的水进入试管丁中。
②试管丁中的NO2与水充分反应后,若向试管内缓缓通入一定量的O2,直至试管全部充满水,则所得溶液中溶质的物质的量浓度是 ____mol·L 1(保留2位有效数值,气体按标准状况计算)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com