
【题目】某无色溶液X,由K+、NH4+、Ba2+、Al3+、Fe3+、CO32-、SO42-中的若干离子组成,取该溶液进行如下实验:

(1)白色沉淀甲是___;
(2)试写出实验过程中生成气体A、B的离子方程式___;
(3)通过上述实验,可确定X溶液中一定存在的阴离子是___;尚未确定是否存在的离子是___;
(4)若要检验溶液中是否含有CO32-离子,其方法是___。
【答案】BaSO4 CO32-+2H+=H2O+CO2↑、NH4++OH-![]() NH3↑+H2O CO32-、SO42- K+ 加盐酸
NH3↑+H2O CO32-、SO42- K+ 加盐酸
【解析】
分析流程图,加入盐酸,有气体A产生,则A一定是CO2,溶液中一定含有CO32-,一定不含有Ba2+、Al3+、Fe3+;加入过量Ba(OH)2溶液,生成的气体B为NH3,溶液中一定含有NH4+;生成的白色沉淀甲为BaSO4,溶液中一定含有SO42-;只有K+不能确定是否存在。
(1)白色沉淀甲是BaSO4。答案为:BaSO4
(2)实验过程中生成气体A的离子方程式为:CO32-+2H+=H2O+CO2↑。
答案为:CO32-+2H+=H2O+CO2↑
生成B的离子方程式NH4++OH-![]() NH3↑+H2O。答案为:NH4++OH-
NH3↑+H2O。答案为:NH4++OH-![]() NH3↑+H2O
NH3↑+H2O
(3)通过上述实验,可确定X溶液中一定存在的阴离子是CO32-、SO42-。
答案为CO32-、SO42-
尚未确定是否存在的离子是K+。答案为:K+
(4)若要检验溶液中是否含有CO32-离子,其方法是加盐酸。
答案为:加盐酸


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】海水开发利用的部分过程如图所示。下列说法错误的是( )
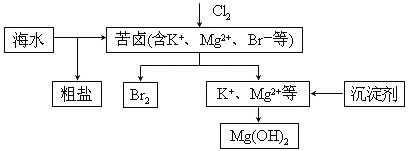
A. 向苦卤中通入Cl2是为了提取溴
B. 工业生产中常选用NaOH作为沉淀剂
C. 粗盐可采用除杂和重结晶等过程提纯
D. 富集溴一般先用空气和水蒸气吹出单质溴,再用![]() 将其还原吸收
将其还原吸收
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于金属保护的说法不正确的是 ( )
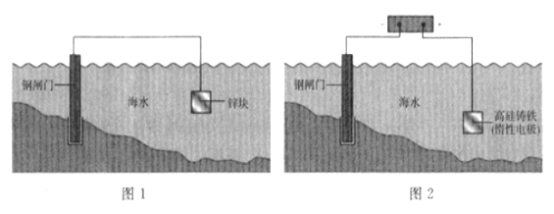
A. 图1是牺牲阳极阴极保护法,图2是外加电流阴极保护法
B. 钢闸门均为电子输入的一端
C. 锌和高硅铸铁的电板反应均为氧化反应
D. 两图所示原理均发生了反应:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列是某学生自己总结的一些规律,其中正确的是
A.有的无机化学反应不属于化合、分解、置换、复分解中的任何一种反应
B.某物质在固态时能导电,可确认该物质是金属单质
C.一种元素在同一物质中可显示不同价态,但一定是该元素的相邻价态
D.氧化物只可能是氧化产物,不可能是还原产物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温时,用![]() 滴定
滴定![]() 某一元酸HX,滴定过程中pH变化曲线如图所示。
某一元酸HX,滴定过程中pH变化曲线如图所示。

下列说法正确的是
A. HX溶液显酸性的原因是![]()
B. 点a,![]()
C. 点b,![]() 与
与![]() 恰好完全反应
恰好完全反应
D. 点c,![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】欲测定含少量氯化钠的小苏打固态样品中NaHCO3的质量分数可用以下四种方法。
方法一:
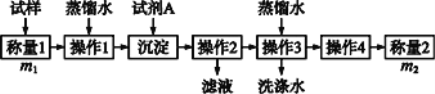
方法二:
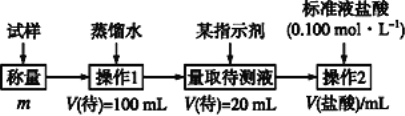
方法三:
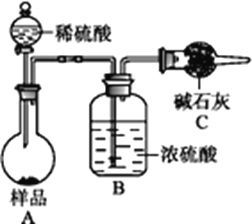
方法四:不使用化学试剂,使用实验室常用仪器。
按要求回答下列问题:
(1)方法一:加入足量的试剂A是___________(填写A的化学式),可将HCO3-转化为沉淀并称重。操作1、2、3、4的名称依次是溶解、____、洗涤和干燥(烘干);
(2)方法二:在操作1中所用到的玻璃仪器中,除了烧杯、玻璃棒、胶头滴管外,还需要用到的是__________,应选择甲基橙作指示剂;
(3)在方法二中计算该样品中NaHCO3的质量分数为_____________;
(4)在方法三中,根据所用的实验装置,除了称量样品质量外,还需测定的实验数据是_____________________;
(5)仔细分析方法三中的实验装置,若由此测得的数据来计算实验结果,则有可能偏高也有可能偏低,偏高的原因可能是_________,偏低的原因可能是__________(均文字简述);
(6)方法四的实验原理是________________(用化学方程式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有2.8gFe全部溶于一定浓度、200ml的HNO3溶液中,得到标准状况下的气体1.12L,测得反应后溶液的pH为1.若反应前后溶液体积变化忽略不计,则下列有关判断不正确的是
A. 反应后溶液中c(NO3-)=0.85mol/L
B. 反应后的溶液最多还能溶解1.4gFe
C. 反应后溶液中铁元素可能以Fe3+形式存在
D. 1.12L气体只能是NO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图在衬白纸的玻璃片中央放置适量的KMnO4颗粒,在周围分别滴加一滴含有酚酞的澄清石灰水、FeCl2溶液,然后在KMnO4晶体上滴加适量的浓盐酸,迅速盖好表面皿。提示:实验室中所用的少量氯气可以用下述原理制取:2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O,此反应在常温下即能进行。
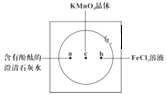
(1)浓盐酸在反应中表现出来的性质是______ (填写编号),氧化剂与还原剂物质的量之比为______ ,氧化产物为______ 。
①只有还原性 ②还原性和酸性
③只有氧化性 ④氧化性和酸性
(2)产生0.1 mol Cl2,则转移电子的物质的量为 ______ mol。
(3)a处反应的化学方程式是___________________________,工业上用此原理制取漂白粉。
(4)b处离子方程式是________________________。
(5)高锰酸钾标准溶液经常用来滴定测量物质的含量。用高锰酸钾法间接测定石灰石中CaCO3的含量的方法为:称取试样0.1250g,用稀盐酸溶解后加入(NH4)2C2O4得CaC2O4沉淀。沉淀经过滤洗涤后溶于稀硫酸中。滴定生成的H2C2O4用去浓度为0.016mo/LKMnO4溶液25.00mL。
①写出CaC2O4沉淀溶解的离子方程式:___________________
②配平并完成下列高锰酸钾滴定草酸反应的离子方程式: ____MnO4-+___H2C2O4+____=___Mn2++___CO2↑+____
③石灰石中CaCO3的百分含量:_______
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com