
【题目】下列关于金属保护的说法不正确的是 ( )
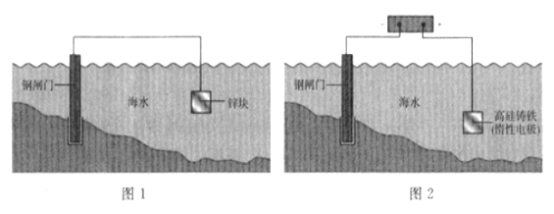
A. 图1是牺牲阳极阴极保护法,图2是外加电流阴极保护法
B. 钢闸门均为电子输入的一端
C. 锌和高硅铸铁的电板反应均为氧化反应
D. 两图所示原理均发生了反应:![]()
【答案】D
【解析】
根据金属的电化学保护原理(原电池和电解池)分析判断。
A项:图1将被保护的钢闸门与较活泼金属锌构成原电池,是牺牲阳极阴极保护法。图2将被保护的钢闸门、惰性电极分别与电源负极、正极相连构成电解池,是外加电流阴极保护,A项正确;
B项:图1中,电子从锌经外电路转移向钢闸门。图2中,电子从电源负极转移向钢闸门,B项正确;
C项:锌是原电池负极,本身发生失电子反应。高硅铸铁是电解池辅助阳极,其它物质在其表面发生失电子反应,C项正确;
D项:图1中原电池正极反应为O2+4e-+2H2O=4OH-、图2中电解池阴极反应![]() 或2H2O+2e-=H2↑+2OH-,D项错误。
或2H2O+2e-=H2↑+2OH-,D项错误。
本题选D。


 全能测控期末小状元系列答案
全能测控期末小状元系列答案科目:高中化学 来源: 题型:
【题目】(1)实验室制氨气的化学方程式为_________________________。
(2)0.1 mol/LNH4Cl溶液中离子浓度由大到小的顺序为____________________。
(3)已知0.5mol的液态甲醇(CH3OH)在空气中完全燃烧生成CO2气体和液态水时放出350kJ的热量,则表示甲醇燃烧热的热化学方程式为______________________。
(4)已知①C(s)+O2(g)= CO2(g) ΔH1=-393 kJ/mol
②2CO(g)+O2(g)= 2CO2(g) ΔH2=-566 kJ/mol
③TiO2(s)+2Cl2(g)= TiCl4(s)+O2(g) ΔH3=+141 kJ/mol
则TiO2(s)+2Cl2(g)+2C(s)= TiCl4(s)+2CO(g)的 ΔH =__________________。
(5)在25℃下,向浓度均为0.1 mol/L的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成沉淀_____(填化学式)(已知25℃时Ksp[Mg(OH)2]=1.8×10-11,KsP[Cu(OH)2]=2.2×10-20)。
(6)常温下,0.lmol/LNaHCO3溶液的pH大于8,则溶液中c(H2CO3)______c(CO32-)(填“>”、“=”或“<”)。
(7)在25℃下,将a mol/L的氨水与0.01 mol/L的盐酸等体积混合,反应完成后溶液中c(NH4+)=c(Cl-),则溶液显_________性(填“酸”“碱”或“中”),a _________0.01 mol/L(填“>”、“=”或“<”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁及其化合物有重要且广泛的应用
(1)基态Fe2+的价层电子排布图为_____________
(2)检验Fe3+可以用KSCN溶液,写出SCN-的一种等电子体分子_______。
(3)部分电离能数据如下表:
元素 | Mn | Fe | |
电离能 |
| 717 | 759 |
| 1 509 | 1 561 | |
| 3 248 | 2 957 | |
根据表中数据可知,气态![]() 再失去一个电子比气态
再失去一个电子比气态![]() 再失去一个电子难,其原因是___________________________。
再失去一个电子难,其原因是___________________________。
(4)过渡金属原子可以与CO分子形成配合物,配合物价电子总数符合“18电子规则”。如Cr可以与CO形成![]() 分子:价电子总数
分子:价电子总数![]() 的价电子数
的价电子数![]() 提供电子数
提供电子数![]() .Fe原子也能与CO形成配合物,其化学式为________.
.Fe原子也能与CO形成配合物,其化学式为________.
(5)已知Fe单质有如图所示的两种常见堆积方式:


其中属于体心立方密堆积的是______![]() 填“a”或“b”
填“a”或“b”![]() ;若单质Fe按a方式紧密堆积,设原子半径为rpm,图中晶胞的棱长为_________
;若单质Fe按a方式紧密堆积,设原子半径为rpm,图中晶胞的棱长为_________
(6)FeS2晶体的晶胞如图(c)所示。晶胞边长为a nm、FeS2相对式量为M,阿伏加德罗常数的值为NA,其晶体密度的计算表达式为___________g·cm3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,体积为1L的密闭容器中,0.3molX和0.2molY进行反应:2X(g)+Y(s) ![]() Z(g),经10s达到平衡,生成0.1molZ。下列说法正确的是( )
Z(g),经10s达到平衡,生成0.1molZ。下列说法正确的是( )
A. 若增加Y的物质的量,则V正大于V逆平衡正向移动
B. 以Y浓度变化表示的反应速率为0.01mol·L-1·s-1
C. 该反应的平衡常数为10
D. 若降低温度,X的体积分数增大,则该反应的△H<0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A元素的一种原子没有中子;B元素的原子得1个电子后形成的离子与氩原子电子数相同;C元素的原子第三层电子数比第二层少2个;D元素的原子与A原子构成的分子A2D有10个电子。则A的元素符号为_____ ;B的离子结构示意图为_________________;C的原子结构示意图为_____________;D的元素名称为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量的CuS和Cu2S的混合物投入足量的HNO3中,收集到气体VL(标况下),向反应后的溶液中(存在Cu2+和SO42-)加入足量NaOH,产生蓝色沉淀,过滤,洗涤,灼烧,得到CuO12.0g,若上述气体为NO和NO2的混合气体,且体积比为1:1,则V可能为( )
A.8.4LB.13.5LC.10.7LD.16.8L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色溶液X,由K+、NH4+、Ba2+、Al3+、Fe3+、CO32-、SO42-中的若干离子组成,取该溶液进行如下实验:

(1)白色沉淀甲是___;
(2)试写出实验过程中生成气体A、B的离子方程式___;
(3)通过上述实验,可确定X溶液中一定存在的阴离子是___;尚未确定是否存在的离子是___;
(4)若要检验溶液中是否含有CO32-离子,其方法是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)阳离子![]() 共有m个电子,则中子数N=_______。
共有m个电子,则中子数N=_______。
(2)某金属氯化物MCl240.5g,含有0.6mol Cl-,则该氯化物的摩尔质量是________。
(3)KClO2属于钾盐,其中氯元素的化合价为_______;KClO2在水溶液中完全电离,则其电离方程式为:_______。
(4)写出分离酒精(沸点为78.1℃)和甲苯(沸点为110.6℃)两种互溶液体的方法_,写出从碘水中提取碘单质的方法_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三种气体X、Y、Z的相对分子质量关系为Mr(X)<Mr(Y)=0.5Mr(Z),下列说法正确的是
A. 原子数目相等的三种气体,质量最大的是Z
B. 同温同压下,同质量的三种气体,气体密度最小的是X
C. 若一定条件下,三种气体体积均为2.24 L,则它们的物质的量一定均为0.1 mol
D. 同温下,体积相同的两容器分别充2 g Y气体和1 g Z气体,则其压强比为2︰1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com