
【题目】(1)阳离子![]() 共有m个电子,则中子数N=_______。
共有m个电子,则中子数N=_______。
(2)某金属氯化物MCl240.5g,含有0.6mol Cl-,则该氯化物的摩尔质量是________。
(3)KClO2属于钾盐,其中氯元素的化合价为_______;KClO2在水溶液中完全电离,则其电离方程式为:_______。
(4)写出分离酒精(沸点为78.1℃)和甲苯(沸点为110.6℃)两种互溶液体的方法_,写出从碘水中提取碘单质的方法_____。
【答案】A-m-n 135g/mol +3 KClO2=K++ ClO2 蒸馏 萃取和分液
【解析】
(1)阳离子![]() 共有m个电子,则X元素的核内含有m+n个质子,结合A=Z+N计算中子数N;
共有m个电子,则X元素的核内含有m+n个质子,结合A=Z+N计算中子数N;
(2)根据M=![]() 来计算;
来计算;
(3)根据KClO2中各元素的化合价的代数和为0,计算氯元素的化合价;KClO2在溶液中完全电离,据此书写电离方程式;
(4)酒精和甲苯二者互溶,但沸点不同;碘在水中的溶解度比在有机物中的溶解度小,据此分析解答。
(1)阳离子![]() 共有m个电子,则X元素的核内含有m+n个质子,则中子数N= A-(m+n)=A-m-n,故答案为:A-m-n;
共有m个电子,则X元素的核内含有m+n个质子,则中子数N= A-(m+n)=A-m-n,故答案为:A-m-n;
(2)含有0.6molCl-,则金属氯化物MCl2的物质的量是![]() =0.3mol,所以该氯化物的摩尔质量M=
=0.3mol,所以该氯化物的摩尔质量M=![]() =135g/mol,故答案为:135g/mol;
=135g/mol,故答案为:135g/mol;
(3)KClO2中K元素的化合价为+1,O元素的化合价为-2,设氯元素的化合价为x,则+1+x+(-2)×2=0,解得x=+3;KClO2在溶液中完全电离出钾离子和ClO2-,其电离方程式为:KClO2=K++ClO2-,故答案为:+3;KClO2=K++ClO2-;
(4)二者互溶,但沸点不同,可以利用沸点的差异来分离,即采用蒸馏法分离;碘在水中的溶解度比在有机物中的溶解度小,可以选择适当的萃取剂进行萃取,即采用萃取分液法分离,故答案为:蒸馏;萃取和分液。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】若某原子在处于能量最低状态时,外围电子排布为![]() ,则下列说法错误的是
,则下列说法错误的是
A. 该元素可能有+3价
B. 该元素位于第5周期副族
C. 该元素原子核外共有39个不同运动状态的电子
D. 该元素基态原子第N能层上还有5个空轨道
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于金属保护的说法不正确的是 ( )
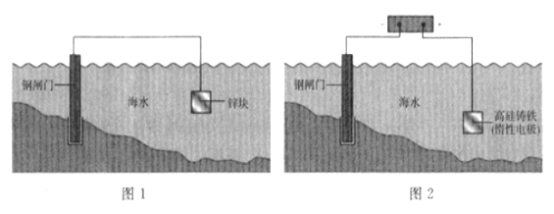
A. 图1是牺牲阳极阴极保护法,图2是外加电流阴极保护法
B. 钢闸门均为电子输入的一端
C. 锌和高硅铸铁的电板反应均为氧化反应
D. 两图所示原理均发生了反应:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温时,用![]() 滴定
滴定![]() 某一元酸HX,滴定过程中pH变化曲线如图所示。
某一元酸HX,滴定过程中pH变化曲线如图所示。

下列说法正确的是
A. HX溶液显酸性的原因是![]()
B. 点a,![]()
C. 点b,![]() 与
与![]() 恰好完全反应
恰好完全反应
D. 点c,![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
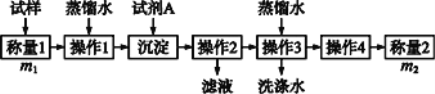
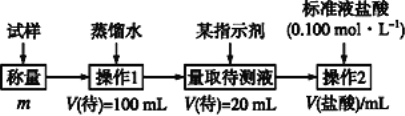
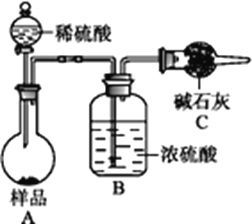
【题目】欲测定含少量氯化钠的小苏打固态样品中NaHCO3的质量分数可用以下四种方法。
方法一:
方法二:
方法三:
方法四:不使用化学试剂,使用实验室常用仪器。
按要求回答下列问题:
(1)方法一:加入足量的试剂A是___________(填写A的化学式),可将HCO3-转化为沉淀并称重。操作1、2、3、4的名称依次是溶解、____、洗涤和干燥(烘干);
(2)方法二:在操作1中所用到的玻璃仪器中,除了烧杯、玻璃棒、胶头滴管外,还需要用到的是__________,应选择甲基橙作指示剂;
(3)在方法二中计算该样品中NaHCO3的质量分数为_____________;
(4)在方法三中,根据所用的实验装置,除了称量样品质量外,还需测定的实验数据是_____________________;
(5)仔细分析方法三中的实验装置,若由此测得的数据来计算实验结果,则有可能偏高也有可能偏低,偏高的原因可能是_________,偏低的原因可能是__________(均文字简述);
(6)方法四的实验原理是________________(用化学方程式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下有关物质的质量分数和物质的量浓度的叙述正确的是
A. 等体积硫酸铁、硫酸铜、硫酸钾溶液分别与足量的氯化钡溶液反应,若生成硫酸钡沉淀的质量相等,则三种硫酸盐溶液的物质的量浓度之比为1:1:1
B. Na2O2和Na2O各0.1mol分别放入100g水中,所得溶液的物质的量浓度不相等
C. 质量分数分别为5%和15%的硫酸溶液等体积混合后,所得溶液的质量分数为大于10%
D. 20℃时,饱和KCl溶液的密度为1.174g.cm-3,物质的量浓度为4.0mol/L ,则此溶液中KCl的质量分数为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有2.8gFe全部溶于一定浓度、200ml的HNO3溶液中,得到标准状况下的气体1.12L,测得反应后溶液的pH为1.若反应前后溶液体积变化忽略不计,则下列有关判断不正确的是
A. 反应后溶液中c(NO3-)=0.85mol/L
B. 反应后的溶液最多还能溶解1.4gFe
C. 反应后溶液中铁元素可能以Fe3+形式存在
D. 1.12L气体只能是NO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数,下列说法正确的是( )
A.1 mol氦气中有2NA个氦原子B.14 g氮气中含6.02×1023个氮分子
C.常温常压下,32gO3含有的原子数为2NAD.18 g水中所含的电子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,相同温度下,在容器Ⅰ和Ⅱ中分别充入等物质的量的HI,发生反应2HI(g) ![]() H2(g)+I2(g)。下列关于反应起始时容器Ⅰ和Ⅱ中活化分子的说法不正确的是( )
H2(g)+I2(g)。下列关于反应起始时容器Ⅰ和Ⅱ中活化分子的说法不正确的是( )
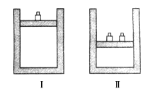
A. Ⅰ和Ⅱ中活化分子数相同
B. Ⅰ和Ⅱ中活化分子百分数相同
C. Ⅰ和Ⅱ中单位体积内活化分子数相等
D. Ⅰ中化学反应速率比Ⅱ中的小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com