
【题目】现有2.8gFe全部溶于一定浓度、200ml的HNO3溶液中,得到标准状况下的气体1.12L,测得反应后溶液的pH为1.若反应前后溶液体积变化忽略不计,则下列有关判断不正确的是
A. 反应后溶液中c(NO3-)=0.85mol/L
B. 反应后的溶液最多还能溶解1.4gFe
C. 反应后溶液中铁元素可能以Fe3+形式存在
D. 1.12L气体只能是NO
【答案】B
【解析】
A.反应后溶液为硝酸铁、硝酸的混合溶液,故溶液中有3c(Fe3+)+c(H+)=c(NO3-),根据铁元素守恒由n(Fe)=n(Fe3+)=0.05mol,所以c(Fe3+)=![]() =0.25mol/L,反应后溶液pH为1,所以c(H+)=0.1mol/L,所以c(NO3-)=0.25mol/L×3+0.1mol/L=0.85mol/L,选项A正确;
=0.25mol/L,反应后溶液pH为1,所以c(H+)=0.1mol/L,所以c(NO3-)=0.25mol/L×3+0.1mol/L=0.85mol/L,选项A正确;
B.由A中分析可知,原硝酸是稀硝酸,反应生成NO,由氮元素守恒可知n原来(HNO3)=3n[Fe(NO3)2]+n剩余(HNO3)+n(NO)=0.05mol×3+0.1mol/L×0.2+0.05mol=0.22mol,生成Fe(NO3)2、NO时原硝酸溶解的铁最多,由3Fe+8HNO3=3Fe(NO3)2+2 NO↑+4H2O 可知,0.22molHNO3最多溶解铁![]() ×0.22mol,质量为
×0.22mol,质量为![]() ×0.22mol×56g/mol=4.62g,故还能溶解铁4.64g-2.8g=1.82g,选项B不正确;
×0.22mol×56g/mol=4.62g,故还能溶解铁4.64g-2.8g=1.82g,选项B不正确;
C.反应后溶液pH为1,故HNO3过量,Fe只可能转化为Fe3+,选项C正确;
D.2.8gFe的物质的量为![]() =0.05mol,若只生成NO,根据电子转移守恒可知,n(NO)=
=0.05mol,若只生成NO,根据电子转移守恒可知,n(NO)=![]() =0.05mol,则V(NO)=0.05mol×22.4L/mol=1.12L;若只生成NO2,根据电子转移守恒可知,n(NO2)=
=0.05mol,则V(NO)=0.05mol×22.4L/mol=1.12L;若只生成NO2,根据电子转移守恒可知,n(NO2)=![]() =0.15mol,V(NO2)=0.15mol×22.4L/mol=3.36L,由于实际生成气体1.12L,故只生成NO, 选项D正确;
=0.15mol,V(NO2)=0.15mol×22.4L/mol=3.36L,由于实际生成气体1.12L,故只生成NO, 选项D正确;
答案选B。


 能考试期末冲刺卷系列答案
能考试期末冲刺卷系列答案科目:高中化学 来源: 题型:
【题目】铁及其化合物有重要且广泛的应用
(1)基态Fe2+的价层电子排布图为_____________
(2)检验Fe3+可以用KSCN溶液,写出SCN-的一种等电子体分子_______。
(3)部分电离能数据如下表:
元素 | Mn | Fe | |
电离能 |
| 717 | 759 |
| 1 509 | 1 561 | |
| 3 248 | 2 957 | |
根据表中数据可知,气态![]() 再失去一个电子比气态
再失去一个电子比气态![]() 再失去一个电子难,其原因是___________________________。
再失去一个电子难,其原因是___________________________。
(4)过渡金属原子可以与CO分子形成配合物,配合物价电子总数符合“18电子规则”。如Cr可以与CO形成![]() 分子:价电子总数
分子:价电子总数![]() 的价电子数
的价电子数![]() 提供电子数
提供电子数![]() .Fe原子也能与CO形成配合物,其化学式为________.
.Fe原子也能与CO形成配合物,其化学式为________.
(5)已知Fe单质有如图所示的两种常见堆积方式:


其中属于体心立方密堆积的是______![]() 填“a”或“b”
填“a”或“b”![]() ;若单质Fe按a方式紧密堆积,设原子半径为rpm,图中晶胞的棱长为_________
;若单质Fe按a方式紧密堆积,设原子半径为rpm,图中晶胞的棱长为_________
(6)FeS2晶体的晶胞如图(c)所示。晶胞边长为a nm、FeS2相对式量为M,阿伏加德罗常数的值为NA,其晶体密度的计算表达式为___________g·cm3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色溶液X,由K+、NH4+、Ba2+、Al3+、Fe3+、CO32-、SO42-中的若干离子组成,取该溶液进行如下实验:

(1)白色沉淀甲是___;
(2)试写出实验过程中生成气体A、B的离子方程式___;
(3)通过上述实验,可确定X溶液中一定存在的阴离子是___;尚未确定是否存在的离子是___;
(4)若要检验溶液中是否含有CO32-离子,其方法是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)阳离子![]() 共有m个电子,则中子数N=_______。
共有m个电子,则中子数N=_______。
(2)某金属氯化物MCl240.5g,含有0.6mol Cl-,则该氯化物的摩尔质量是________。
(3)KClO2属于钾盐,其中氯元素的化合价为_______;KClO2在水溶液中完全电离,则其电离方程式为:_______。
(4)写出分离酒精(沸点为78.1℃)和甲苯(沸点为110.6℃)两种互溶液体的方法_,写出从碘水中提取碘单质的方法_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校化学实验小组设计下图装置制备氯气,图中涉及气体发生、除杂、干燥、收集及尾气处理装置。
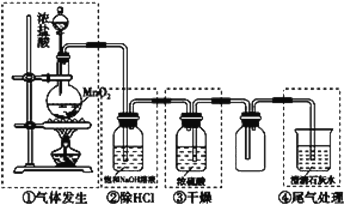
(1)上述装置中,错误的是____________(选填字母)。
A.①②④ B.②③④ C.①③④ D.①②③
(2)写出装置①中发生反应的化学方程式是___________________,将收集到的纯净氯气通入到碘化钾溶液中,再向其中加入四氯化碳振荡后静置,最终的实验现象是_____,发生反应的化学方程式是___________________。
(3)生产氯气的工业称为“氯碱工业”,写出化学方程式______________。
(4)久置氯水的漂白作用会失效,写出发生该反应的化学方程式__________。
(5)工业上用氯气生产漂白粉的化学反应方程式为_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学在实验室欲配制物质的量浓度均为1.0mol/L的NaOH溶液、稀硫酸各450ml.提供的试剂是:NaOH固体、98%的浓硫酸(密度为1.84g/cm3)和蒸馏水.

(1)请你观察图示判断其中不正确的操作有_________(填序号).
(2)应用托盘天平称量NaOH_______g,应用量筒量取浓硫酸________mL.
(3)浓硫酸溶于水的正确操作方法是_________________________
(4)在配制H2SO4溶液实验中,下列操作引起结果偏高的有___________
A.该学生在量取浓硫酸时,俯视刻度线
B.溶解硫酸后没有冷却至室温就立即完成后面的配制操作
C.在烧杯中溶解搅拌时,溅出少量溶液
D.没有用蒸馏水洗涤烧杯2~3次,并将洗液移入容量瓶中
E.将量筒洗涤2~3次,并全部转移至容量瓶中
F.容量瓶中原来存有少量蒸馏水
G.胶头滴管加水定容时俯视刻度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三种气体X、Y、Z的相对分子质量关系为Mr(X)<Mr(Y)=0.5Mr(Z),下列说法正确的是
A. 原子数目相等的三种气体,质量最大的是Z
B. 同温同压下,同质量的三种气体,气体密度最小的是X
C. 若一定条件下,三种气体体积均为2.24 L,则它们的物质的量一定均为0.1 mol
D. 同温下,体积相同的两容器分别充2 g Y气体和1 g Z气体,则其压强比为2︰1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一般较强酸可制取较弱酸,这是复分解反应的规律之一。已知在常温下测得浓度均为0.1mol/L的下列 3 种溶液的 pH:
溶质 | NaHCO3 | Na2CO3 | NaClO |
pH | 8.34 | 11.6 | 10.3 |
下列有关说法正确的是( )
A. 以上溶液的 pH 是用广泛 pH 试纸测定的
B. 反应CO2+H2O+2NaClO=Na2CO3+2HClO可以发生
C. 室温下,电离常数: K2( H2CO3)>K( HClO)
D. 在新制氯水中加入少量 NaHCO3固体可以提高溶液中 HClO 的浓度
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com