
【题目】下列化学用语正确的是
A. 异戊烷的键线式:![]() B. 乙烯的结构简式:CH2CH2
B. 乙烯的结构简式:CH2CH2
C. 苯乙烯(![]() )的实验式:CH2D. 乙酸分子的球棍模型:
)的实验式:CH2D. 乙酸分子的球棍模型: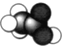
【答案】A
【解析】
A. 键线式是表示有机物结构式的方式之一,指只用键线来表示碳骨架,而分子中的碳氢键、碳原子及与碳原子相连的氢原子均被省略,其他杂原子及与杂原子相连的氢原子须保留的表示方法;
B. 乙烯分子中含有碳碳双键,其结构简式中必须标出碳碳双键;
C. 实验式为分子中各原子的最简比;
D. 根据球棍模型与比例模型的表示方法分析。
A. 异戊烷分子内的2号碳原子上有一个甲基,其键线式为:![]() ,故A项正确;
,故A项正确;
B. 乙烯分子中含有的官能团为碳碳双键,其结构简式为:CH2=CH2,故B项错误;
C. 苯乙烯的分子式为C8H8,其实验式为CH,故C项错误;
D. ![]() 为乙酸的比例模型,而乙酸的球棍模型为
为乙酸的比例模型,而乙酸的球棍模型为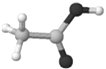 ,故D项错误;
,故D项错误;
答案选A。


科目:高中化学 来源: 题型:
【题目】欲测定含少量氯化钠的小苏打固态样品中NaHCO3的质量分数可用以下四种方法。
方法一:
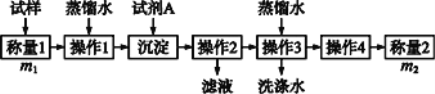
方法二:
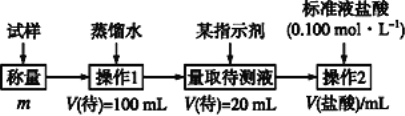
方法三:
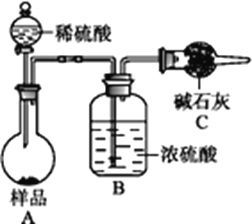
方法四:不使用化学试剂,使用实验室常用仪器。
按要求回答下列问题:
(1)方法一:加入足量的试剂A是___________(填写A的化学式),可将HCO3-转化为沉淀并称重。操作1、2、3、4的名称依次是溶解、____、洗涤和干燥(烘干);
(2)方法二:在操作1中所用到的玻璃仪器中,除了烧杯、玻璃棒、胶头滴管外,还需要用到的是__________,应选择甲基橙作指示剂;
(3)在方法二中计算该样品中NaHCO3的质量分数为_____________;
(4)在方法三中,根据所用的实验装置,除了称量样品质量外,还需测定的实验数据是_____________________;
(5)仔细分析方法三中的实验装置,若由此测得的数据来计算实验结果,则有可能偏高也有可能偏低,偏高的原因可能是_________,偏低的原因可能是__________(均文字简述);
(6)方法四的实验原理是________________(用化学方程式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有2.8gFe全部溶于一定浓度、200ml的HNO3溶液中,得到标准状况下的气体1.12L,测得反应后溶液的pH为1.若反应前后溶液体积变化忽略不计,则下列有关判断不正确的是
A. 反应后溶液中c(NO3-)=0.85mol/L
B. 反应后的溶液最多还能溶解1.4gFe
C. 反应后溶液中铁元素可能以Fe3+形式存在
D. 1.12L气体只能是NO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学实验室使用的浓盐酸的溶质的质量分数通常为36.5%,密度为1.25g/mL。
(1)该盐酸的物质的量浓度为__________mol/L。
(2)现有一种0.2mol/L的稀盐酸的含义是_________(选填字母)。
A.1L水中含有0.2mol HCl
B.1L溶液中含有0.1mol H+
C.将7.1gHCl溶于1L水所配成的溶液
D.从100mL该溶液中取出10mL,剩余溶液的物质的量浓度仍为0.2mol/L
(3)用上述实验室的浓盐酸来配制500mL1 mol/L的稀盐酸,请在下列操作步骤中填写有关的空格:
①用量筒量取________mL的浓盐酸;(精确到小数点后一位)
②向盛有少量蒸馏水的烧杯中,沿_________慢慢注入浓盐酸;
③将已冷却至室温的盐酸溶液沿玻璃棒注入________mL的容量瓶中;
④用少量蒸馏水洗涤烧杯2~3次,并将洗涤液也全部转移到容量瓶中;
⑤继续向容量瓶中加蒸馏水,直至液面接近刻度线1~2cm处;
⑥改用___________________逐滴加蒸馏水,使溶液凹液面恰好与刻度线相切;
⑦盖好容量瓶塞,反复颠倒,摇匀;
⑧将配好的稀硫酸倒入试剂瓶中,贴好标签。
(4)由于操作不当,会引起实验误差。下列情况对所配制的盐酸溶液的物质的量浓度有何影响?(用“偏高”、“偏低”、“无影响”填空)
①容量瓶用蒸馏水洗涤后残留有少量的水_____________;
②定容时,某同学观察液面的情况如图所示_____________;
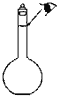
③摇匀后,发现溶液的液面低于刻度线,又加水至刻度线____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数,下列说法正确的是( )
A.1 mol氦气中有2NA个氦原子B.14 g氮气中含6.02×1023个氮分子
C.常温常压下,32gO3含有的原子数为2NAD.18 g水中所含的电子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用16mol/L 浓硫酸配制100mL 2.0mol/L 稀硫酸的实验步骤如下:①计算所用浓硫酸的体积 ②量取一定体积的浓硫酸 ③溶解 ④转移、洗涤 ⑤定容 ⑥摇匀。回答下列问题:
(1)该实验所需的玻璃仪器:______、玻璃棒、烧杯、胶头滴管、量筒。
(2)所需浓硫酸的体积是_____,量取浓硫酸所用的量筒的规格是____(规格从下列中选用A.10mL B.20mL C.50mL D.100mL)。
(3)第⑤步定容的具体实验操作是_______。
(4)下列情况对所配制的稀硫酸浓度有何影响?(用偏大、偏小、无影响填写)
A.容量瓶用蒸馏水洗涤后残留有少量的水____。
B.转移溶液前未冷却至室温_____。
C.定容时仰视溶液的凹液面______。
D. 向容量瓶中转移溶液时,不慎有少量溶液洒在容量瓶外面____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图在衬白纸的玻璃片中央放置适量的KMnO4颗粒,在周围分别滴加一滴含有酚酞的澄清石灰水、FeCl2溶液,然后在KMnO4晶体上滴加适量的浓盐酸,迅速盖好表面皿。提示:实验室中所用的少量氯气可以用下述原理制取:2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O,此反应在常温下即能进行。
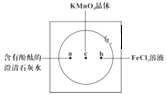
(1)浓盐酸在反应中表现出来的性质是______ (填写编号),氧化剂与还原剂物质的量之比为______ ,氧化产物为______ 。
①只有还原性 ②还原性和酸性
③只有氧化性 ④氧化性和酸性
(2)产生0.1 mol Cl2,则转移电子的物质的量为 ______ mol。
(3)a处反应的化学方程式是___________________________,工业上用此原理制取漂白粉。
(4)b处离子方程式是________________________。
(5)高锰酸钾标准溶液经常用来滴定测量物质的含量。用高锰酸钾法间接测定石灰石中CaCO3的含量的方法为:称取试样0.1250g,用稀盐酸溶解后加入(NH4)2C2O4得CaC2O4沉淀。沉淀经过滤洗涤后溶于稀硫酸中。滴定生成的H2C2O4用去浓度为0.016mo/LKMnO4溶液25.00mL。
①写出CaC2O4沉淀溶解的离子方程式:___________________
②配平并完成下列高锰酸钾滴定草酸反应的离子方程式: ____MnO4-+___H2C2O4+____=___Mn2++___CO2↑+____
③石灰石中CaCO3的百分含量:_______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二茂铁(![]() )广泛应用于航天、化工等领域中,其电化学制备原理如图所示,其中电解液为溶解有溴化钠(电解质)和环戊二烯的DMF溶液(DMF为惰性有机溶剂),下列说法正确的是( )
)广泛应用于航天、化工等领域中,其电化学制备原理如图所示,其中电解液为溶解有溴化钠(电解质)和环戊二烯的DMF溶液(DMF为惰性有机溶剂),下列说法正确的是( )
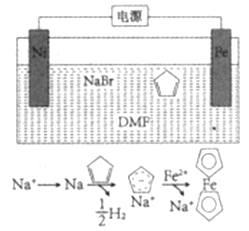
A. 该电解池的阳极反应Fe-3e-=Fe3+
B. DMF溶液可用水替代
C. 电解液中钠离子起到催化剂的作用
D. 该过程中消耗2mol环戊二烯理论上产生22.4L的H2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com