
【题目】二茂铁(![]() )广泛应用于航天、化工等领域中,其电化学制备原理如图所示,其中电解液为溶解有溴化钠(电解质)和环戊二烯的DMF溶液(DMF为惰性有机溶剂),下列说法正确的是( )
)广泛应用于航天、化工等领域中,其电化学制备原理如图所示,其中电解液为溶解有溴化钠(电解质)和环戊二烯的DMF溶液(DMF为惰性有机溶剂),下列说法正确的是( )
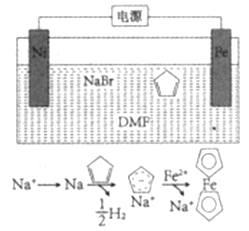
A. 该电解池的阳极反应Fe-3e-=Fe3+
B. DMF溶液可用水替代
C. 电解液中钠离子起到催化剂的作用
D. 该过程中消耗2mol环戊二烯理论上产生22.4L的H2
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】工业上电解 Na2CO3的原理如图所示。下列说法不正确的是( )

A. 阴极产生的物质 A 是 H2
B. 电解一段时间后,阳极附近溶液的 PH 将增大
C. 该离子交换膜应为阳离子交换膜
D. 阳极电极反应为 4CO32-+2H2O-4e-=4HCO3-+O2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一般较强酸可制取较弱酸,这是复分解反应的规律之一。已知在常温下测得浓度均为0.1mol/L的下列 3 种溶液的 pH:
溶质 | NaHCO3 | Na2CO3 | NaClO |
pH | 8.34 | 11.6 | 10.3 |
下列有关说法正确的是( )
A. 以上溶液的 pH 是用广泛 pH 试纸测定的
B. 反应CO2+H2O+2NaClO=Na2CO3+2HClO可以发生
C. 室温下,电离常数: K2( H2CO3)>K( HClO)
D. 在新制氯水中加入少量 NaHCO3固体可以提高溶液中 HClO 的浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知NA为阿伏加德罗常数,下列说法中不正确的是( )
A.常温常压下,16gO2和O3的混合气体中含有N A个原子
B.17克OH-所含电子数目为10NA
C.标准状况下,11.2L氩气中含有0.5NA个氦原子
D.1L2mol·L-1的硫酸镁溶液中含有的氧原子为8NA个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,Na2CO3溶液存在水解平衡:CO32-+H2O![]() HCO3-+OH-。下列说法正确的是( )
HCO3-+OH-。下列说法正确的是( )
A. 稀释溶液,水解平衡向逆反应方向移动,水解程度减小
B. 通入CO2,平衡向正反应方向移动
C. 升高温度,c(HCO3-)/c(CO32-)减小
D. 加入NaOH固体,溶液pH减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CuCl和CuCl2都是重要的化工原料,常用作催化剂、颜料、防腐剂和消毒剂等。
已知:①CuCl可以由CuCl2用适当的还原剂如SO2,SnCl2等还原制得:2Cu2++2Cl-+SO2+2H2O![]() 2CuCl↓+4H++SO42-,2CuCl2+SnCl2=2CuCl↓+SnCl4,②CuCl2溶液与乙二胺(H2N—CH2—CH2—NH2)可形成配离子:
2CuCl↓+4H++SO42-,2CuCl2+SnCl2=2CuCl↓+SnCl4,②CuCl2溶液与乙二胺(H2N—CH2—CH2—NH2)可形成配离子:  。
。
请回答下列问题:
(1)基态Cu原子的核外电子排布式为_____;H、N、O三种元素的电负性由大到小的顺序是____。
(2)SO2分子的空间构型为________;与SnCl4互为等电子体的一种离子的化学式为________。
(3)乙二胺分子中氮原子轨道的杂化类型为________。乙二胺和三甲胺[N(CH3)3]均属于胺,但乙二胺比三甲胺的沸点高得多,原因是__________。
(4)②中所形成的配离子中含有的化学键类型有______(填字母)。
A.配位键 B.极性键 C.离子键 D.非极性键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室需要0.1mol/LNaOH溶液450mL和0.5mol/L硫酸溶液450mL。根据这两种溶液的配制情况回答下列问题:
(1)如图所示的仪器中配制溶液肯定不需要的是_________(填序号),本实验所用玻璃仪器E的规格和名称为_____________。

(2)下列操作中,容量瓶所不具备的功能有__________(填序号)
a.配制一定体积准确浓度的标准溶液 b.长期贮存溶液
c.用来加热溶解固体溶质 d.量取220毫升体积的液
(3)如果实验室有l0mL、25mL、50mL量筒,根据计算得知:量取质量分数为98%、密度为1.84g.cm-3的浓硫酸应选用__________mL规格的量筒最好。
(4)在配制NaOH溶液实验中,其他操作均正确,若定容时仰视刻度线,则所配制溶液浓度_______0.1mol/L(填“大于”“等于”或“小于”,下同)。若NaOH溶液未冷却即转移至容量瓶定容,则所配制溶液浓度__________0.1mol/L。
(5)如果定容时不小心超过刻度线,应如何操作__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com