
【题目】CuCl和CuCl2都是重要的化工原料,常用作催化剂、颜料、防腐剂和消毒剂等。
已知:①CuCl可以由CuCl2用适当的还原剂如SO2,SnCl2等还原制得:2Cu2++2Cl-+SO2+2H2O![]() 2CuCl↓+4H++SO42-,2CuCl2+SnCl2=2CuCl↓+SnCl4,②CuCl2溶液与乙二胺(H2N—CH2—CH2—NH2)可形成配离子:
2CuCl↓+4H++SO42-,2CuCl2+SnCl2=2CuCl↓+SnCl4,②CuCl2溶液与乙二胺(H2N—CH2—CH2—NH2)可形成配离子:  。
。
请回答下列问题:
(1)基态Cu原子的核外电子排布式为_____;H、N、O三种元素的电负性由大到小的顺序是____。
(2)SO2分子的空间构型为________;与SnCl4互为等电子体的一种离子的化学式为________。
(3)乙二胺分子中氮原子轨道的杂化类型为________。乙二胺和三甲胺[N(CH3)3]均属于胺,但乙二胺比三甲胺的沸点高得多,原因是__________。
(4)②中所形成的配离子中含有的化学键类型有______(填字母)。
A.配位键 B.极性键 C.离子键 D.非极性键
【答案】[Ar]3d104s1 O>N>H V形 SO42—、SiO44— sp3杂化 乙二胺分子间能形成氢键而三甲胺分子之间不能形成氢键 ABD
【解析】
(1)根据铜的原子序数为29,结合能量最低原理书写基态原子的电子排布式;根据电负性的变化规律比较电负性大小;(2)根据SO2分子含有的δ键以及孤电子对数判断空间构型;根据SnCl4含有的最外层电子数为50,以及含有5个原子判断等电子体;(3)根据价层电子对数判断乙二胺(H2N—CH2—CH2—NH2)分子中氮原子的杂化类型,根据是否含有氢键分析二者熔沸点高低不同的原因;(4)根据成键原子的特点,结合化学键的类型判断。
(1)铜的原子序数为29,根据能量最低原理基态原子的电子排布式为1s22s22p63s23p63d104s1或[Ar]3d104s1;在元素周期表中同一周期从左到右元素的电负性逐渐增强,同一主族从上到下元素的电负性逐渐减弱,可知电负性强弱顺序为O>N>H,故答案为:1s22s22p63s23p63d104s1或[Ar]3d104s1;O>N>H;
(2)SO2分子中含有2个δ键,孤电子对数=![]() =1,所以分子的空间构型为V形,SnCl4含有的价层电子数为50,并含有5个原子,与之互为等电子体的离子有SO42-、SiO44-等,故答案为:V形;SO42-、SiO44-等;
=1,所以分子的空间构型为V形,SnCl4含有的价层电子数为50,并含有5个原子,与之互为等电子体的离子有SO42-、SiO44-等,故答案为:V形;SO42-、SiO44-等;
(3)乙二胺(H2N—CH2—CH2—NH2)分子中氮原子形成4个δ键,价层电子对数为4,氮原子为sp3杂化,乙二胺分子间可以形成氢键,物质的熔沸点较高,而三甲胺分子间不能形成氢键,熔沸点较低,故答案为:sp3杂化;乙二胺分子间可以形成氢键,三甲胺分子间不能形成氢键;
(4)②中所形成的配离子(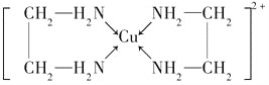 )中含有的化学键有N与Cu之间为配位键,C-C键为非极性键,C-N、N-H、C-H键为极性键,不含离子键,故答案为:ABD。
)中含有的化学键有N与Cu之间为配位键,C-C键为非极性键,C-N、N-H、C-H键为极性键,不含离子键,故答案为:ABD。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】如图在衬白纸的玻璃片中央放置适量的KMnO4颗粒,在周围分别滴加一滴含有酚酞的澄清石灰水、FeCl2溶液,然后在KMnO4晶体上滴加适量的浓盐酸,迅速盖好表面皿。提示:实验室中所用的少量氯气可以用下述原理制取:2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O,此反应在常温下即能进行。
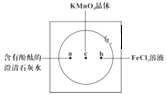
(1)浓盐酸在反应中表现出来的性质是______ (填写编号),氧化剂与还原剂物质的量之比为______ ,氧化产物为______ 。
①只有还原性 ②还原性和酸性
③只有氧化性 ④氧化性和酸性
(2)产生0.1 mol Cl2,则转移电子的物质的量为 ______ mol。
(3)a处反应的化学方程式是___________________________,工业上用此原理制取漂白粉。
(4)b处离子方程式是________________________。
(5)高锰酸钾标准溶液经常用来滴定测量物质的含量。用高锰酸钾法间接测定石灰石中CaCO3的含量的方法为:称取试样0.1250g,用稀盐酸溶解后加入(NH4)2C2O4得CaC2O4沉淀。沉淀经过滤洗涤后溶于稀硫酸中。滴定生成的H2C2O4用去浓度为0.016mo/LKMnO4溶液25.00mL。
①写出CaC2O4沉淀溶解的离子方程式:___________________
②配平并完成下列高锰酸钾滴定草酸反应的离子方程式: ____MnO4-+___H2C2O4+____=___Mn2++___CO2↑+____
③石灰石中CaCO3的百分含量:_______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二茂铁(![]() )广泛应用于航天、化工等领域中,其电化学制备原理如图所示,其中电解液为溶解有溴化钠(电解质)和环戊二烯的DMF溶液(DMF为惰性有机溶剂),下列说法正确的是( )
)广泛应用于航天、化工等领域中,其电化学制备原理如图所示,其中电解液为溶解有溴化钠(电解质)和环戊二烯的DMF溶液(DMF为惰性有机溶剂),下列说法正确的是( )
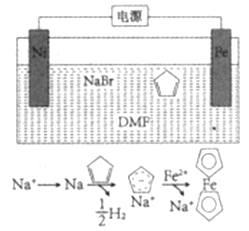
A. 该电解池的阳极反应Fe-3e-=Fe3+
B. DMF溶液可用水替代
C. 电解液中钠离子起到催化剂的作用
D. 该过程中消耗2mol环戊二烯理论上产生22.4L的H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A. ![]() 氨水加水稀释后,溶液中所有离子的浓度都减小
氨水加水稀释后,溶液中所有离子的浓度都减小
B. 将![]() 溶液与
溶液与![]() 溶液混合可制取
溶液混合可制取![]()
C. 直接蒸干![]() 溶液就可以得到
溶液就可以得到![]() 固体
固体
D. 浓度相同的①![]() ;②
;②![]() ;③
;③![]() 。三种溶液中的
。三种溶液中的![]() :③>①>②
:③>①>②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于0.1 mol·L-1 Na2SO4溶液的叙述中,正确的是
A.从1 L该溶液中取出100 mL,则取出溶液中Na2SO4的物质的量浓度为 0.01 mol·L-1
B.0.5 L该溶液中钠离子的物质的量0.1 mol·L-1
C.1 L该溶液中含有Na2SO4的质量为142 g
D.取该溶液10mL,加水稀释至100 mL后Na2SO4的物质的量浓度为0.01 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用邻苯二甲酸氢钾溶液来滴定NaOH溶液有下列操作:
①向溶液中加入1~2滴指示剂
②取20.00 mL标准溶液放入锥形瓶中
③用NaOH溶液滴定至终点(终点时溶液的pH约为9.1)
④重复以上操作
⑤用天平精确称取一定量的邻苯二甲酸氢钾固体配成250 mL标准溶液(测得pH约为4.2)
⑥根据实验数据计算NaOH的物质的量浓度
(1)以上各步中,正确的(填序号)操作顺序是________,上述②中使用的仪器除锥形瓶外,还需要使用的仪器是________,选用指示剂是________。
(2)滴定,并记录NaOH的终读数.重复滴定几次,数据记录如下表:

某同学在处理数据过程中计算得到平均消耗NaOH溶液的体积为V(NaOH)=(19.98+20.00+20.80+20.02)/4mL=20.20mL,他的计算合理吗?理由是__________。
(3)步骤②中在观察滴定管的起始读数时,要使滴定管的尖嘴部分充满溶液,如果滴定管内部有气泡,赶走气泡的操作__________;滴定前用蒸馏水洗净碱式滴定管,然后加NaOH溶液进行滴定,此操作对实验结果________(填“偏大”、“偏小”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图中,A为一种常见的单质,B、C、D、E是含有A元素的常见化合物。它们的焰色实验均为黄色。
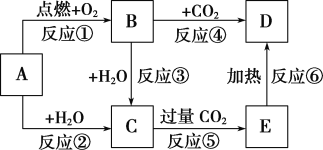
(1)写出下列物质的化学式:B________;E___________。
(2)以上6个反应中属于氧化还原反应的有________(填写编号)。
(3)写出B→C反应的离子方程式:________________________________________;
C→E的化学方程式:____________________________________________;
E→D的化学方程式:___________________________________________;
(4)加热5.00 g D和E的固体混合物,使E完全分解,固体混合物的质量减少了0.31 g,则原混合物中D的质量为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“要想做好实验,就要敏于观察。”——波义耳。体弱多病的波义耳为给自己治病自修医 学,到处寻方问药。自己配制药物,所以研究医学必须研制药物和做实验。下列有关实验的 选项正确的是( )
A.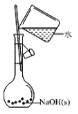 配制 0.10 mol/L NaOH 溶液B.
配制 0.10 mol/L NaOH 溶液B. 除去 CO 中的 CO2
除去 CO 中的 CO2
C.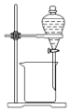 用来分离乙醇和水D.
用来分离乙醇和水D.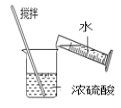 稀释浓硫酸
稀释浓硫酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是一种表示集合的图案,该图案中由左到右分别写了H2O、CO2、Na2O、NaCl、FeCl3五种物质,图中相连的两种物质均可归属为一类,相交部分由左到右A、B、C、D为其相应的分类依据代号。请回答下列问题:
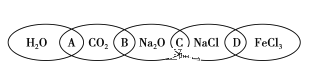
(1)请将分类依据代号填入相应的括号内:
(_____)两种物质都是非金属氧化物
(_____)两种物质都是钠的化合物
(_____)两种物质中一种是酸性氧化物,一种是碱性氧化物
(_____)两种物质都是盐
(2)用洁净的烧杯取少量蒸馏水,用酒精灯加热至沸腾,向烧杯中逐滴加入上图中某种物质M的水溶液,继续煮沸可制得一种红褐色胶体。
①物质M的化学式为____。
②证明有红褐色胶体生成的最常用的实验操作是____。
③生成该胶体的化学方程式为___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com