
����Ŀ����ͼ�У�AΪһ�ֳ����ĵ��ʣ�B��C��D��E�Ǻ���AԪ�صij�����������ǵ���ɫʵ���Ϊ��ɫ��
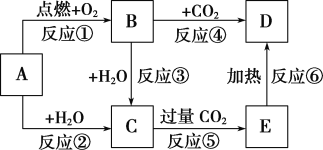
(1)д���������ʵĻ�ѧʽ��B________��E___________��
(2)����6����Ӧ������������ԭ��Ӧ����________(��д���)��
(3)д��B��C��Ӧ�����ӷ���ʽ��________________________________________��
C��E�Ļ�ѧ����ʽ��____________________________________________��
E��D�Ļ�ѧ����ʽ��___________________________________________��
(4)����5.00 g D��E�Ĺ������ʹE��ȫ�ֽ⣬�������������������0.31 g����ԭ�������D������Ϊ_________��
���𰸡�Na2O2 NaHCO3 �٢ڢۢ� 2Na2O2��2H2O��4Na����4OH����O2�� NaOH��CO2��NaHCO3 2NaHCO3![]() Na2CO3��CO2����H2O 4.16 g
Na2CO3��CO2����H2O 4.16 g
��������
AΪһ�ֳ����ĵ��ʣ�B��C��D��E�Ǻ���AԪ�صij�����������ǵ���ɫ��Ӧ��Ϊ��ɫ�����Ϊ�Ƶĵ��ʻ������AΪNa�����ת����ϵ��֪��BΪNa2O2��CΪNaOH��DΪNa2CO3��EΪNaHCO3��
AΪNa�����ת����ϵ��֪��BΪNa2O2��CΪNaOH��DΪNa2CO3��EΪNaHCO3��
��1����������ķ�����֪��BΪNa2O2��EΪNaHCO3���ʴ�Ϊ��Na2O2��NaHCO3��
��2�����Ϸ�Ӧ�Т�Ϊ�Ƶ�ȼ�գ���ΪNa��ˮ��Ӧ����Ϊ����������ˮ��Ӧ����Ϊ���������������̼��Ӧ��������������ԭ��Ӧ���ʴ�Ϊ���٢ڢۢܣ�
��3��B��C�Ļ�ѧ����ʽΪ2Na2O2+2H2O��4NaOH+O2�������ӷ���ʽΪ2Na2O2��2H2O��4Na����4OH����O2����C��E��Ӧ�Ļ�ѧ����ʽΪ��NaOH��CO2��NaHCO3��E��D�Ļ�ѧ����ʽ��2NaHCO3![]() Na2CO3��CO2����H2O��
Na2CO3��CO2����H2O��
��4��̼���ƽ��ȶ������Ȳ��ֽ⣬ֻ��̼�����Ʒֽ⣬�������к���xg NaHCO3����
2NaHCO3 ![]() Na2CO3+CO2��+H2O ��m
Na2CO3+CO2��+H2O ��m
2��84 62
xg 0.31g
2��84��62=xg��0.31g�����x=0.84������m��Na2CO3��=5g-m��NaHCO3��=5g-0.84g=4.16g��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ�ϵ�� Na2CO3��ԭ����ͼ��ʾ������˵������ȷ����( )

A. �������������� A �� H2
B. ���һ��ʱ�������������Һ�� PH ������
C. �����ӽ���ĤӦΪ�����ӽ���Ĥ
D. �����缫��ӦΪ 4CO32-+2H2O-4e-=4HCO3-+O2��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ�������£�Na2CO3��Һ����ˮ��ƽ�⣺CO32-��H2O![]() HCO3-��OH��������˵����ȷ����(����)
HCO3-��OH��������˵����ȷ����(����)
A. ϡ����Һ��ˮ��ƽ�����淴Ӧ�����ƶ���ˮ��̶ȼ�С
B. ͨ��CO2��ƽ��������Ӧ�����ƶ�
C. �����¶ȣ�c(HCO3-)/c(CO32-)��С
D. ����NaOH���壬��ҺpH��С
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��CuCl��CuCl2������Ҫ�Ļ���ԭ�ϣ����������������ϡ����������������ȡ�
��֪����CuCl������CuCl2���ʵ��Ļ�ԭ����SO2��SnCl2�Ȼ�ԭ�Ƶã�2Cu2����2Cl����SO2��2H2O![]() 2CuCl����4H����SO42-,2CuCl2��SnCl2=2CuCl����SnCl4,��CuCl2��Һ���Ҷ���(H2N��CH2��CH2��NH2)���γ������ӣ�
2CuCl����4H����SO42-,2CuCl2��SnCl2=2CuCl����SnCl4,��CuCl2��Һ���Ҷ���(H2N��CH2��CH2��NH2)���γ������ӣ�  ��
��
��ش��������⣺
(1)��̬Cuԭ�ӵĺ�������Ų�ʽΪ_____��H��N��O����Ԫ�صĵ縺���ɴ�С��˳����____��
(2)SO2���ӵĿռ乹��Ϊ________����SnCl4��Ϊ�ȵ������һ�����ӵĻ�ѧʽΪ________��
(3)�Ҷ��������е�ԭ�ӹ�����ӻ�����Ϊ________���Ҷ��������װ�[N(CH3)3]�����ڰ������Ҷ��������װ��ķе�ߵö࣬ԭ����__________��
(4)�������γɵ��������к��еĻ�ѧ��������______(����ĸ)��
A����λ�� B�����Լ� C�����Ӽ� D���Ǽ��Լ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�¶��£�����ĥ���þ������ʢ��![]() ����ˮ���ձ��У���pH���������Ƕȴ����������Һ�е�pH���Ƕ���ʱ��ı仯����ͼ��ʾ��ʵ�߱�ʾ��ҺpH��ʱ��ı仯���������й���������ȷ���ǣ� ��
����ˮ���ձ��У���pH���������Ƕȴ����������Һ�е�pH���Ƕ���ʱ��ı仯����ͼ��ʾ��ʵ�߱�ʾ��ҺpH��ʱ��ı仯���������й���������ȷ���ǣ� ��

A. ��ʵ�����ڼ��������½��е�
B. ���¶���![]() ��Ksp��������ԼΪ
��Ksp��������ԼΪ![]()
C. 50sʱ������Һ�е����̪��Һ����Һ��Ϊ��ɫ
D. 150s����Һ�Ƕ��½�����Ϊ���ɵ�![]() ���ܽ�
���ܽ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�л���Ľṹ��ʽΪ![]() �����й��ڸ����ʵ�˵��������ȷ����
�����й��ڸ����ʵ�˵��������ȷ����
A. �����ʲ��ܷ�����ȥ��Ӧ��������һ�������·����Ӿ۷�Ӧ
B. �����ʲ��ܺ�AgNO3��Һ��Ӧ����AgBr����
C. ��������NaOH�Ĵ���Һ�м��ȿ�ת��Ϊ����
D. �����ʿ�ʹ��ˮ��ɫ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���±���A��B��C��D�����л�����й���Ϣ��
A | ����ʹ������Ȼ�̼��Һ��ɫ�� ������ˮ��һ�������·�Ӧ����C�� �۱���ģ��Ϊ�� |
B | ����C��H����Ԫ����ɣ� �����ģ��Ϊ�� |
C | ����C��H��O����Ԫ����ɣ� ������Na��Ӧ����������NaOH��Һ��Ӧ�� ��������ѻ�Ϊͬ���칹�塣 |
D | ����Է���������C������2�� ����������C�������ɡ� |
���ݱ�����Ϣ�ش��������⣺
��1��A��������Ȼ�̼��Һ��Ӧ�������������Ϊ___________��ϵͳ����������д������������������NaOHˮ��Һ���ȵĻ�ѧ����ʽ___________��
��2��A�����������ӳɷ�Ӧ�����ɷ���F����F�ڷ�����ɺͽṹ�����Ƶ��л�����һ����(�׳���ͬϵ����)�����Ǿ�����ͨʽCnH2n��2����n��________ʱ�������л��↑ʼ����ͬ���칹�塣
��3��B���е�������________(�����)������ɫ��ζҺ�塢���ж����۲�����ˮ�����ܶȱ�ˮ�ݸ������������Һ����ˮ��Ӧ��ɫ�����κ������²���������Ӧ��д����Ũ���������£�B��Ũ���ᷴӦ�Ļ�ѧ����ʽΪ: _______
��4��д����C��������D�Ļ�ѧ����ʽ________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ������Ҫ0.1mol/LNaOH��Һ450mL��0.5mol/L������Һ450mL��������������Һ����������ش��������⣺
��1����ͼ��ʾ��������������Һ�϶�����Ҫ����_________������ţ�����ʵ�����ò�������E�Ĺ�������Ϊ_____________��

��2�����в����У�����ƿ�����߱��Ĺ�����__________������ţ�
a������һ�����ȷŨ�ȵı���Һ b������������Һ
c�����������ܽ�������� d����ȡ220���������Һ
��3�����ʵ������l0mL��25mL��50mL��Ͳ�����ݼ����֪����ȡ��������Ϊ98%���ܶ�Ϊ1.84g.cm-3��Ũ����Ӧѡ��__________mL������Ͳ��á�
��4��������NaOH��Һʵ���У�������������ȷ��������ʱ���ӿ̶��ߣ�����������ҺŨ��_______0.1mol/L������������������������С��������ͬ������NaOH��Һδ��ȴ��ת��������ƿ���ݣ�����������ҺŨ��__________0.1mol/L��
��5���������ʱ��С�ij����̶��ߣ�Ӧ��β���__________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������ʵ������������ܵó���Ӧ���۵���
ѡ�� | ʵ����� | ���� | ���� |
A |
| ��Һ��ɫ��ȥ |
|
B | ��1mL 2mol/L | �����ɰ�ɫ�����������ɺ��ɫ���� |
|
C | �� | ��Һ��Ϊ��ɫ | ��Ʒ�Ѳ��ֻ�ȫ������ |
D | ��ˮ�Ҵ��м���Ũ���ᣬ���ȣ�����������Yͨ������ | ��Һ��ɫ��ȥ | ����Y�к�����ϩ |
A. AB. BC. CD. D
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com