
【题目】下表是A、B、C、D四种有机物的有关信息:
A | ①能使溴的四氯化碳溶液褪色; ②能与水在一定条件下反应生成C; ③比例模型为: |
B | ①由C、H两种元素组成; ②球棍模型为: |
C | ①由C、H、O三种元素组成; ②能与Na反应,但不能与NaOH溶液反应; ③与二甲醚互为同分异构体。 |
D | ①相对分子质量比C物质少2; ②能由物质C氧化而成。 |
根据表中信息回答下列问题:
(1)A与溴的四氯化碳溶液反应的生成物的名称为___________(系统命名法);写出该生成物与足量的NaOH水溶液共热的化学方程式___________。
(2)A与氢气发生加成反应后生成分子F,与F在分子组成和结构上相似的有机物有一大类(俗称“同系物”),它们均符合通式CnH2n+2。当n=________时,这类有机物开始出现同分异构体。
(3)B具有的性质是________(填序号):①无色无味液体、②有毒、③不溶于水、④密度比水大、⑤高锰酸钾酸性溶液和溴水反应褪色、⑥任何条件下不与氢气反应;写出在浓硫酸作用下,B与浓硝酸反应的化学方程式为: _______
(4)写出由C氧化生成D的化学方程式________。
【答案】1,2二溴乙烷 CH2Br CH2Br +2NaOH ![]() HOCH2 CH2OH +2NaBr 4 ②③
HOCH2 CH2OH +2NaBr 4 ②③ ![]() +HO—NO2
+HO—NO2![]()
![]() +H2O 2CH3CH2OH+O2
+H2O 2CH3CH2OH+O2![]() 2CH3CHO+2H2O
2CH3CHO+2H2O
【解析】
A能使溴的四氯化碳溶液褪色说明含有碳碳双键或三键,结合其比例模型,可知A为CH2=CH2;A能和水反应生成C,C由C、H、O三种元素组成,能与Na反应,但不能与NaOH溶液反应,则C为CH3CH2OH;根据B的组成元素及其球棍模型知,B是![]() ;D的相对分子质量比C少2,且能由C氧化生成,所以D是CH3CHO,据此解答。
;D的相对分子质量比C少2,且能由C氧化生成,所以D是CH3CHO,据此解答。
(1)A为CH2=CH2,与溴的四氯化碳溶液反应的生成物的名称为1,2-二溴乙烷;1,2-二溴乙烷与足量的NaOH水溶液共热发生水解反应,反应的化学方程式为CH2Br CH2Br +2NaOH ![]() HOCH2 CH2OH +2NaBr;故答案为:1,2-二溴乙烷;CH2Br CH2Br +2NaOH
HOCH2 CH2OH +2NaBr;故答案为:1,2-二溴乙烷;CH2Br CH2Br +2NaOH ![]() HOCH2 CH2OH +2NaBr;
HOCH2 CH2OH +2NaBr;
(2)A与氢气发生加成反应后生成物质F,F为乙烷,当烷烃中碳原子数目为4时开始出现同分异构体,故答案为:4;
(3)B是苯,结构简式为![]() ,分子式为C6H6,苯是无色有特殊气味的液体,有毒,不溶于水,密度小于水,性质较稳定,和酸性高锰酸钾溶液、溴水都不反应,但能萃取溴水中的溴而使溴水褪色,一定条件下能和氢气发生加成反应生成环己烷,与浓硝酸反应的化学方程式:
,分子式为C6H6,苯是无色有特殊气味的液体,有毒,不溶于水,密度小于水,性质较稳定,和酸性高锰酸钾溶液、溴水都不反应,但能萃取溴水中的溴而使溴水褪色,一定条件下能和氢气发生加成反应生成环己烷,与浓硝酸反应的化学方程式:![]() + HO-NO2
+ HO-NO2![]()
![]() +H2O,故答案为:②③;
+H2O,故答案为:②③;![]() + HO-NO2
+ HO-NO2![]()
![]() +H2O;
+H2O;
(4)乙醇能被氧化生成乙醛,反应方程式为:2CH3CH2OH+O2![]() 2CH3CHO+2H2O,故答案为:2CH3CH2OH+O2
2CH3CHO+2H2O,故答案为:2CH3CH2OH+O2![]() 2CH3CHO+2H2O。
2CH3CHO+2H2O。


科目:高中化学 来源: 题型:
【题目】下列关于难溶电解质溶解平衡的说法正确的是
A. 可直接根据 Ksp 的数值大小比较难溶电解质在水中的溶解度大小
B. 在 AgCl 的饱和溶液中,加入蒸馏水, Ksp(AgCl)不变
C. 难溶电解质的溶解平衡过程是可逆的,且在平衡状态时 v溶解=v沉淀=0
D. 25℃时, Ksp(AgCl)>Ksp(AgI),向 AgCl 的饱和溶液中加入少量 KI 固体,一定有黄色沉
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于0.1 mol·L-1 Na2SO4溶液的叙述中,正确的是
A.从1 L该溶液中取出100 mL,则取出溶液中Na2SO4的物质的量浓度为 0.01 mol·L-1
B.0.5 L该溶液中钠离子的物质的量0.1 mol·L-1
C.1 L该溶液中含有Na2SO4的质量为142 g
D.取该溶液10mL,加水稀释至100 mL后Na2SO4的物质的量浓度为0.01 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图中,A为一种常见的单质,B、C、D、E是含有A元素的常见化合物。它们的焰色实验均为黄色。
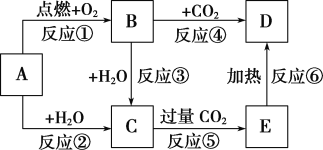
(1)写出下列物质的化学式:B________;E___________。
(2)以上6个反应中属于氧化还原反应的有________(填写编号)。
(3)写出B→C反应的离子方程式:________________________________________;
C→E的化学方程式:____________________________________________;
E→D的化学方程式:___________________________________________;
(4)加热5.00 g D和E的固体混合物,使E完全分解,固体混合物的质量减少了0.31 g,则原混合物中D的质量为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)15.6gNa2X固体中含有0.4molNa+,则该化合物的摩尔质量为______,将这些Na2X固体溶解到水中,并加水稀释至2L,则所得溶液中Na+的物质的量浓度为____ mol·L-1。
(2)电解饱和食盐水的化学方程式为___________,若时消耗117gNaCl,则理论上最多可得到_____ L(标准状况)氯气。
(3)若将2mol氯气通入足量石灰乳中,理论上可得到次氯酸钙________克?(写出具体计算过程)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“要想做好实验,就要敏于观察。”——波义耳。体弱多病的波义耳为给自己治病自修医 学,到处寻方问药。自己配制药物,所以研究医学必须研制药物和做实验。下列有关实验的 选项正确的是( )
A.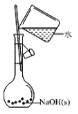 配制 0.10 mol/L NaOH 溶液B.
配制 0.10 mol/L NaOH 溶液B. 除去 CO 中的 CO2
除去 CO 中的 CO2
C.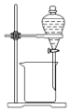 用来分离乙醇和水D.
用来分离乙醇和水D.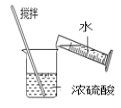 稀释浓硫酸
稀释浓硫酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一个密闭容器,中间有一可自由滑动的隔板(厚度不计)将容器分成两部分,当左边充入8molN2,右边充入CO和CO2的混合气体共64g时,隔板处于如图位置(保持温度不变),下列说法正确的是

A. 左边CO和CO2分子数之比为1:3
B. 右边CO的质量为14g
C. 右边气体密度是相同条件下氧气密度的2倍
D. 若改变右边CO和CO2的充入量而使隔板处于距离右端![]() 处,若保持温度不变,则前后两次容器内的压强之比为5:6
处,若保持温度不变,则前后两次容器内的压强之比为5:6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1684 年,波义耳出版了一部名为《人血的自然史略》的医学著作,在这本书里, 他总结了自己在血液分析方面的实验成果。这是有史以来,人类第一次将化学分析方法用于 临床医学。通过实验,波义耳证明了血液中含有氯化钠,并将之称为固定盐。科研人员从海水得到的粗盐中含有泥沙等不溶性杂质,以及可溶性杂质:Ca2+,Mg2+,SO42-等,提纯的流程如下图:
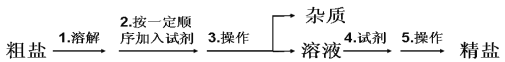
(1)整个流程中首先将粗盐溶解,再通过以下实验步骤进行提纯:①过滤②加过量 NaOH 溶 液③加适量盐酸④加过量 Na2CO3 溶液⑤加过量 BaCl2 溶液。
以下操作顺序不合理的是_____(填字母)
A.②⑤④③① B.④⑤②①③ C.⑤②④①③ D.⑤④②①③
除去 Mg2+的离子方程式_________。
(2)实验室将上述得到的精制食盐水制成精盐的过程中,还需要进行某一操作,该操作中 需要加热的仪器为:_____。
(3)下列实验仪器,可用酒精灯直接加热的是_______(填字母)
①试管 ②量筒 ③圆底烧瓶 ④烧杯 ⑤容量瓶 ⑥锥形瓶 ⑦燃烧匙
A. ①③④⑥⑦ B. ①⑦ C. ①③④⑤⑥ D. ①②③④⑤⑥⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,将0.10mol·L-1盐酸滴入20.00 mL 0.10mol·L-1氨水中,溶液中pH和pOH随加入盐酸体积变化曲线如图所示。已知:pOH=-lg c(OH-),下列说法正确的是

A. M点所示溶液中c(NH4+)+c(NH3·H2O)=c(Cl-)
B. N点所示溶液中c(NH4+)>c(Cl-)
C. Q点消耗盐酸的体积等于氨水的体积
D. M点和N点所示溶液中水的电离程度相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com