
现有稀硫酸和稀硝酸的混合溶液,已知其中稀硫酸浓度为4mol/L,稀硝酸的浓度为2mol/L。取10mL混合酸,向其中加入过量铁粉,反应结束后,在标准状况下可收集到气体体积为(假设HNO3只被还原为NO)
| A.0.224L | B.0.448L | C.0.672L | D.0.896L |
科目:高中化学 来源: 题型:单选题
NaNO2有像食盐一样的外观和咸味,它对人体的毒性表现为:可将正常的血红蛋白变为高铁血红蛋白(使血红蛋白中的铁元素由二价变为三价),失去携氧能力,美蓝是亚硝酸盐中毒的有效解毒剂。下列有关NaNO2毒性分析正确的是
| A.因解毒剂美蓝具有氧化性 | B.中毒时亚硝酸盐发生氧化反应 |
| C.解毒时高铁血红蛋白被还原 | D.中毒时血红蛋白分子被还原 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
溴化碘(IBr)的化学性质很像卤素的单质,它能与大多数金属、非金属化合生成卤化物,它也能与水发生以下反应:IBr+H2O=HBr+HIO,下列有关IBr的叙述中,不正确的是( )。
| A.在很多反应中IBr是强氧化剂 |
| B.IBr与水反应时既作氧化剂,又作还原剂 |
| C.IBr与AgNO3溶液反应会生成AgBr沉淀 |
| D.IBr与NaOH溶液反应时,生成NaBr和NaIO |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
甲、乙、丙三种溶液各含一种X-(X-为Cl-、Br-、I-),向甲中加淀粉溶液和新制的氯水变为橙色,将此溶液倒入丙中,颜色无明显变化。则甲、乙、丙中依次含有( )
| A.Br-、Cl-、I- | B.Br-、I-、Cl- |
| C.I-、Br-、Cl- | D.Cl-、I-、Br- |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
以下有关实验原理及结论正确的是( )
| A.XCl3的溶液能与铜片发生反应,则铜的金属性一定比X强 |
| B.金属X能与NaOH溶液反应放出H2,但金属Y不能,则Y的金属性一定比X弱 |
| C.非金属X能将Fe氧化到+3价,但非金属Y不能,则Y的氧化性一定比X强 |
| D.Na2SO3溶液使酸性KMnO4溶液褪色:5SO32—+6H++2MnO4—=5SO42—+2Mn2++3H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
a mol FeS与b mol Fe3O4投入到V L c mol·L-1的硝酸溶液中恰好完全反应,假设只产生NO气体。所得澄清溶液的成分是Fe(NO3)3和H2SO4的混合液,则反应中未被还原的硝酸为( )
| A.(a+3b) mol | B.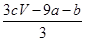 mol mol |
C.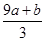 mol mol | D.(cV-3a-9b) mol |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
事实上,许多氧化物在一定条件下能与Na2O2反应,且反应极有规律,如Na2O2+SO2=Na2SO4,2Na2O2+2SO3=2Na2SO4+O2,据此你认为下列反应方程式中不正确的是( )
| A.Na2O2+N2O3=NaNO2+NaNO3 |
| B.Na2O2+2NO2=2NaNO2+O2 |
| C.Na2O2+N2O4=2NaNO3 |
| D.2Na2O2+2Mn2O7=4NaMnO4+O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列说法正确的是 ( )。
A.根据反应Cu+H2SO4 CuSO4+H2↑可推出Cu的还原性比H2的强 CuSO4+H2↑可推出Cu的还原性比H2的强 |
| B.在反应CaH2+2H2O=Ca(OH)2+2H2↑中,水作氧化剂 |
| C.反应3NO2+H2O=2HNO3+NO中氧化剂和还原剂的物质的量之比是3∶1 |
| D.因Cl2的氧化性强于I2的氧化性,所以置换反应I2+2NaClO3=2NaIO3+Cl2不能发生 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com