
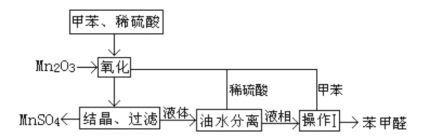
����Ŀ������ȩ��ҽҩ��Ⱦ�ϡ����ϵ���ҵ���Ź㷺��Ӧ�á�ʵ����ͨ����ͼ��ʾ�������ɼױ������Ʊ�����ȩ��
�Իش��������⣺
��1��Mn2O3�����ױ��ķ�Ӧ��Ҫ���Ͻ��裬�����������___��
��2���ױ���������õ��Ļ����ͨ���ᾧ�����˽��з��룬�ù������轫�������ȴ����Ŀ��___��
��3��ʵ������У���ѭ��ʹ�õ����ʷֱ�Ϊ___��___��
��4��ʵ���з���ױ��ͱ���ȩ���õIJ���I��___________��
��5��ʵ���з��֣���Ӧʱ�䲻ͬ����ȩ�IJ���Ҳ��ͬ(���ݼ��±�)��
��Ӧʱ��/h | 1 | 2 | 3 | 4 | 5 |
����ȩ����/% | 76.0 | 87.5 | 83.6 | 72.5 | 64.8 |
���ϱ���ȩ�Ľṹ����������Ӧʱ�����ʱ������ȩ�����½���ԭ��___��
���𰸡�ʹ��Ӧ���ֽӴ�������Ӧ���� ����MnSO4���ܽ�� ϡ���� �ױ� ���� ���ֱ���ȩ���������˱�����
��������
����ͼʾ���̿�֪���ױ��������̡�ϡ���ᷴӦ���������̡�����ȩ��ͨ���ᾧ�����˷���������̣�����Һ������ˮ���롢���������ñ���ȩ������ϡ����ͼױ�����ѭ�����ã�
(1)����Mn2O3��Һ̬�ױ���Ӧ���Ӵ����С����Ӧ���ʽ������ʷ�Ӧʱ����н��裬ʹ��Ӧ���ֽӴ�������Ӧ���ʣ�
��Ϊ��ʹ��Ӧ���ֽӴ�������Ӧ���ʣ�
(2)���û�����к�MnSO4 ����ȩ�ȣ�Ϊʹ������轵��MnSO4���ܽ�ȣ�������Ҫ��ȴ����Ϊ������MnSO4���ܽ�ȣ�
(3)��������Ӧ������ͼ��֪������ѭ��������������ϡH2SO4�ͼױ���
��Ϊ��ϡ����ױ���
(4)�ױ��ͱ���ȩ����ܽ���л����������е�IJ��죬��������ķ������룻
��������
(5)����ȩ���Ļ�ԭ�Խ�ǿ������ȩ�ױ�O2�������ɱ����ᣬ�ʷ�Ӧ����ʱ��Խ��������Խ�ͣ�
��Ϊ�����ֱ���ȩ���������˱����ᡣ



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ᣨH3BO3����һ��Ƭ��״�ṹ��ɫ���壬����ʯī���ƵIJ�״�ṹ�������ֽ⣬���ڵ�H3BO3����ͨ�������������ͼ��ʾ�����������й�˵���в���ȷ����

A. �����ᾧ�����ڷ��Ӿ���
B. ��������ӵ��ȶ����������
C. 1molH3BO3�������3mol���
D. Bԭ���ӻ����������sp2������H3BO3����ͨ�����ۼ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����14�֣�������Ϊ��ɫ�ᾧ����ɫ��ĩ��������ˮ����Ҫ����ұ�𡢻���������������ҵ��Ŀǰ�ҹ����÷����ᣨH2SiF6�������������ж��ַ���������̼��Ʒ����Ʊ������Ƶij����������乤��������ͼ��ʾ����ش��������⣺
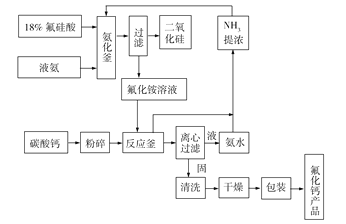
��1��өʯ���н϶�ķ����ƣ������ֹ����У�Ҫ����������өʯ���Ʋ�өʯ����Ҫ������________������ĸ����
A����ԭ�� B�����ۼ� C�����¼� D����̼��
��2����д���������з�Ӧ�Ļ�ѧ����ʽ��_______________________________��
��3����Ӧ���в����������壬����ˮ��һ�������ԣ�һ���Լ��ԣ���д����Ӧ���з�Ӧ�����ӷ���ʽ��__________________________________��
��4���Ӿ���Ч��ͻ���Ч���Ϸ�����������Ϊ�˽�Լ��Դ��������Ҫ�Ĵ�����ѭ�����õ�������________��
��5����������CaCO3��ԭ�ϵ��ŵ�Ϊ___________________________________����д��������������֪3Ca(OH)2+H2SiF6![]() 3CaF2+SiO2+4H2O���������˷����Ʊ�CaF2������ѵ���______________��
3CaF2+SiO2+4H2O���������˷����Ʊ�CaF2������ѵ���______________��
��6����1 t 18%������Ϊԭ�ϣ�������������̼��Ʒ��Ʊ�CaF2�����ϴ�ӡ���������õ�0.25 t ������CaF2�������CaF2�IJ���Ϊ__________%��������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��5������������������Ҫ���л��ϳ��м��壬��������Ȼ���ʰ������صĺϳɣ�һ���Լ䱽����Ϊԭ�ϵĺϳɷ�Ӧ���£�

�״������Ѻ�3��5�������������ӵIJ����������ʼ��±���
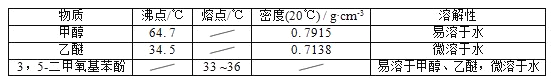
��1����Ӧ�������ȷ�����״����ټ������ѽ�����ȡ���ٷ�����״��IJ����ǵ�______������ȡ�õ��ķ�Һ©��ʹ��ǰ��__________________��ϴ������Һʱ�л����ڷ�Һ©����________����ϡ����¡����㣻
��2������õ����л��������ñ���NaHCO3��Һ������ʳ��ˮ����������ˮ����ϴ�ӣ��ñ���NaHCO3��Һϴ�ӵ�Ŀ����__���ñ���ʳ��ˮϴ�ӵ�Ŀ����______��
��3��ϴ����ɺ�ͨ�����²������롢�ᴿ�����ȷ�IJ���˳����__������ĸ����
a�������ȥ���� b���ؽᾧ c�����˳�ȥ����� d��������ˮCaCl2����
��4����Һ���볣���ü�ѹ���ˣ�Ϊ�˷�ֹ��������ѹ������ɺ�Ӧ��________________����______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������һ�ֳ���ˮ����������ʳ���������Ѹɣ�����֮�⣬���ѻ���������ơ�
(1)��������֭���������ǵķ����ǣ������мӼ�������ԣ��ټ������Ƶ�Cu(OH)2�����ȣ���������________��
(2)��������ƹ����У�������ת��Ϊ�ƾ��Ĺ������£�����������л�ѧ����ʽ��C6H12O6(������)![]() 2_________+ 2 C2H5OH
2_________+ 2 C2H5OH
(3)���Ѿ��ܷⴢ������л���������ζ�����࣬����Ҳ����ͨ����ѧʵ�����Ʊ���ʵ���ҿ�����ͼ��ʾװ���Ʊ�����������

���Թ�a���������������Ļ�ѧ����ʽ��__________��
���Թ�b��ʢ�ŵ��Լ��DZ���____________��Һ��
��ʵ�鿪ʼʱ���Թ�b�еĵ��ܲ�����Һ���µ�ԭ����________��
����Ҫ������Թ�b�е�������������Ҫ�õ���������_______(����ĸ)��
A.��ͨ©�� B.��Һ©�� C.����©��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ��Դ���ճ�����߿Ƽ������ж��й㷺Ӧ�á�����˵������ȷ����
A.  Zn2+��Cu�缫�����ƶ���Cu�缫������Һ��H+Ũ������
Zn2+��Cu�缫�����ƶ���Cu�缫������Һ��H+Ũ������
B.  �����ĵ缫��ӦʽΪAg2O��2e��H2O2Ag��2OH
�����ĵ缫��ӦʽΪAg2O��2e��H2O2Ag��2OH
C.  пͲ������������������Ӧ��пͲ��䱡
пͲ������������������Ӧ��пͲ��䱡
D.  ʹ��һ��ʱ��������Һ�����Լ��������������½�
ʹ��һ��ʱ��������Һ�����Լ��������������½�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(1)�����£���0.5 mol/L�Ĵ�����Һ�м�������ˮ����ˮ�������c(H+)��c(OH-)_______ (��������С���������䡱)��
(2)��֪Ksp(Ag2CrO4)=1.0��10-12����0.2 moL��AgNO3��Һ�м���������0.08 mol/L K2CrO4��Һ������Һ�е�c(CrO42-)=________��
(3)�����£�0.1 mol/L NaHCO3��Һ��pHֵ________0.1 mol/LNa2SO3��Һ��pHֵ(�����������������=��)��
��֪��
�� | ����ƽ�ⳣ�� | |
H2CO3 | K1=4.3��10-7 | K2=5.6��10-11 |
H2SO3 | K1=1.54��10-2 | K2=1.02��10-7 |
(4)��һ�ֿɳ����Na��Al/FeS����ع���ʱNa+�����ʵ������ֲ��䣬�������ú�![]() �ĵ��������Ϊ����ʣ���֪�õ��������ӦʽΪ2Na++FeS+2e-=Na2S+Fe���õ���ڳ��ʱ������������Ӧ��������________���ŵ�ʱ������ӦʽΪ________��
�ĵ��������Ϊ����ʣ���֪�õ��������ӦʽΪ2Na++FeS+2e-=Na2S+Fe���õ���ڳ��ʱ������������Ӧ��������________���ŵ�ʱ������ӦʽΪ________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������仯����������������Ӧ����㷺�����������ͺ����²��ϵ�Ӧ�ñ��ܹ�ע���ɴ˲�����![]() �ȷ������������ش�
�ȷ������������ش�
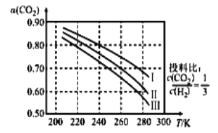
��1����![]() Ӧ�����������ȼ�ϼ״������ܻ�������ЧӦ��Ӱ�죬����Ϊ��Դ���Ʊ������µ���������ϳɷ�ӦΪ
Ӧ�����������ȼ�ϼ״������ܻ�������ЧӦ��Ӱ�죬����Ϊ��Դ���Ʊ������µ���������ϳɷ�ӦΪ![]() ����ͼΪ
����ͼΪ![]() ƽ��ת���ʺ��¶ȡ�ѹǿ�Ĺ�ϵ������ѹǿ�ֱ�Ϊ
ƽ��ת���ʺ��¶ȡ�ѹǿ�Ĺ�ϵ������ѹǿ�ֱ�Ϊ![]() ����ͼ��֪���÷�ӦΪ_______��Ӧ����������������������������
����ͼ��֪���÷�ӦΪ_______��Ӧ����������������������������![]() �ij�ʼŨ��Ϊ
�ij�ʼŨ��Ϊ![]() ������
������![]() ʱ�����ݼ���÷�Ӧ��ƽ�ⳣ��
ʱ�����ݼ���÷�Ӧ��ƽ�ⳣ��![]() _________����ʽ���ɣ�����4.0Mpaʱ��СͶ�ϱ�
_________����ʽ���ɣ�����4.0Mpaʱ��СͶ�ϱ�![]() ����
����![]() ��ƽ��ת�������߿���λ��II�ߵ�_________�������Ϸ��������·�������
��ƽ��ת�������߿���λ��II�ߵ�_________�������Ϸ��������·�������
��2��![]() ʱ����ij�����ܱ������м���һ������
ʱ����ij�����ܱ������м���һ������![]() ��
��![]() ��������Ӧ
��������Ӧ![]() ����Ӧ�ﵽƽ�����
����Ӧ�ﵽƽ�����![]() ʱ�̣��ı�ij������
ʱ�̣��ı�ij������![]() ��ʱ�䣨t���ı仯��ϵ��ͼ1��ʾ����
��ʱ�䣨t���ı仯��ϵ��ͼ1��ʾ����![]() ʱ�̸ı������������______����д��ĸ����
ʱ�̸ı������������______����д��ĸ����
a �����¶Ȳ��䣬ѹ������ b ����������䣬�����¶�
c ����������䣬������̼�� d ����������䣬����![]() Ũ��
Ũ��
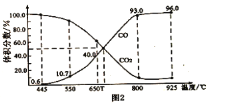
��3����һ���¶��£���ij����ɱ�ĺ�ѹ�ܱ�������p�ܣ�����1molCO2��������̼��������Ӧ![]() ��ƽ��ʱ��ϵ����������������¶ȵĹ�ϵ��ͼ2��ʾ����650��ʱ���÷�Ӧ��ƽ������յ�������___________KJ����
��ƽ��ʱ��ϵ����������������¶ȵĹ�ϵ��ͼ2��ʾ����650��ʱ���÷�Ӧ��ƽ������յ�������___________KJ����![]() �Ļ�����壬ƽ��_______________���������������������������������ƶ���
�Ļ�����壬ƽ��_______________���������������������������������ƶ���
��4����֪25��ʱ��![]() �����¶�������ʵ����������100mL 5 molL1FeCl3��Һ��Ϊʹ���ƹ����в����ֻ���������������Ҫ����2 molL1������___________mL�����Լ��������������
�����¶�������ʵ����������100mL 5 molL1FeCl3��Һ��Ϊʹ���ƹ����в����ֻ���������������Ҫ����2 molL1������___________mL�����Լ��������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪ij��ȼ�Ϻ���̼���⡢������Ԫ�ء�Ϊ�˲ⶨ����ȼ����̼��������Ԫ�ص������ȣ��ɽ���̬ȼ�Ϸ���������O2��ȼ�գ���ʹ����������ȫ��ͨ����ͼ��ʾװ���У��õ���������е�ʵ����(���������������ȫ������)��
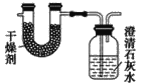
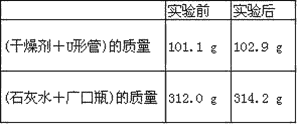
����ʵ��������
(1)ʵ����Ϻ���������ˮ������Ϊ________g��������ƿ������һ�����Σ�������Ϊ_____________g��
(2)���ɵ�ˮ����Ԫ�ص�����Ϊ_______g��
(3)���ɵĶ�����̼��̼Ԫ�ص�����Ϊ_______ g��
(4)��ȼ����̼Ԫ������Ԫ�ص�������Ϊ_______��
(5)��֪����ȼ�ϵ�ÿ�������к���һ����ԭ�ӣ����ȼ�ϵķ���ʽΪ_______���ṹ��ʽΪ_______��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com