
【题目】(1)室温下,在0.5 mol/L的纯碱溶液中加入少量水,由水电离出的c(H+)·c(OH-)_______ (填“变大”、“变小”、“不变”)。
(2)已知Ksp(Ag2CrO4)=1.0×10-12,向0.2 moL的AgNO3溶液中加入等体积的0.08 mol/L K2CrO4溶液,则溶液中的c(CrO42-)=________。
(3)室温下,0.1 mol/L NaHCO3溶液的pH值________0.1 mol/LNa2SO3溶液的pH值(填“>”、“<”、“=”)。
已知:
酸 | 电离平衡常数 | |
H2CO3 | K1=4.3×10-7 | K2=5.6×10-11 |
H2SO3 | K1=1.54×10-2 | K2=1.02×10-7 |
(4)有一种可充电电池Na—Al/FeS,电池工作时Na+的物质的量保持不变,并且是用含![]() 的导电固体作为电解质,已知该电池正极反应式为2Na++FeS+2e-=Na2S+Fe,该电池在充电时,阳极发生反应的物质是________,放电时负极反应式为________。
的导电固体作为电解质,已知该电池正极反应式为2Na++FeS+2e-=Na2S+Fe,该电池在充电时,阳极发生反应的物质是________,放电时负极反应式为________。
【答案】变小 2.5×10-9 mol/L < Na2S、Fe Na-e-=Na+
【解析】
(1)纯碱溶液中加入水稀释,促进碳酸根离子的水解,溶液中水电离出的氢氧根离子浓度减小,氢离子浓度减小,则由水电离出的c(H+)·c(OH-)变小;
(2)假设溶液的体积是V L,n(AgNO3)=0.2V mol,n(K2CrO4)=0.08V mol,AgNO3溶液与K2CrO4溶液等体积混合发生反应:2Ag++CrO42-=Ag2CrO4↓,可见反应后Ag+过量,其物质的量n(Ag+)过量=(0.2V-2×0.08V) mol=0.04V mol,则c(Ag+)过量=![]() =0.02 mol/L,由于Ksp(Ag2CrO4)=1.0×10-12,所以溶液中c(CrO42-)=
=0.02 mol/L,由于Ksp(Ag2CrO4)=1.0×10-12,所以溶液中c(CrO42-)=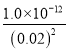 mol/L=2.5×10-9 mol/L;
mol/L=2.5×10-9 mol/L;
(3)根据酸的电离平衡常数大小可知:K1(H2CO3)>K2(H2SO3),根据盐的水解规律:有弱才水解,谁弱水水解,谁强显谁性,越弱越水解,可知等浓度的盐的水解程度:Na2SO3>NaHCO3,由于这两种盐都是强碱弱酸盐,水解显碱性,所以等浓度的盐溶液的碱性:Na2SO3>NaHCO3,则等浓度盐溶液的pH 关系为:NaHCO3<Na2SO3;
(4)在该装置的物质中,Na性质活泼,易失去电子而被氧化,为原电池的负极,负极的电极反应式为2Na-2e-=2Na+,又知该电池中正极的电极反应式为:2Na++FeS+2e-=Na2S+Fe,充电时,阳极发生氧化反应,电极方程式为Na2S+Fe-2e-=2Na++FeS,则阳极发生反应的物质是Na2S、Fe。


科目:高中化学 来源: 题型:
【题目】标准状况下,等体积的NH3和CH4两种气体,下列有关说法错误的是
A.所含分子数目相同B.所含氢原子物质的量之比为3∶4
C.质量之比为16∶17D.密度之比为17∶16
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】继密胺树脂/石墨烯量子点复合微球新型白光发光材料后,2019年8月13日中国科学院福建物质结构研究所合成了首例缺陷诱导的晶态无机硼酸盐单一组分白光材料Ba2[Sn(OH)6][B(OH)4]2并获得了该化合物的LED器件。
(1)基态O原子能量最高的电子,其电子云在空间有___个延展方向;硼原子的基态电子排布图为____。
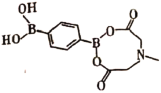
(2)NO3-与SO3互为等电子体,构型为___;苯-1,4-二硼酸甲基亚氨基二乙酸酯结构如图所示,硼原子和氮原子的杂化方式分别为___、____。
(3)Fe3+可用SCN-检验,其对应的酸有两种,分别为硫氰酸(H-S-C≡N)和异硫氰酸(H-N=C=S),这两种酸中沸点较高的是___,试分析其原因______。
(4)微量元素硼和镁对植物的叶的生长和人体骨骼的健康有着十分重要的作用,其化合物也应用广泛。①三价B易形成配离子,如[BH4]-等。写出[BH4]-的一种阳离子等电子体___。
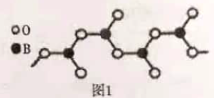
②如图1示多硼酸根的一种无限长的链式结构,其化学式可表示为_____(以n表示硼原子的个数)。
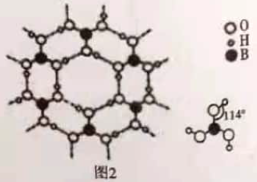
③硼酸晶体是片层结构,如图2表示的是其中一层的结构。每一层内存在的作用力有_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
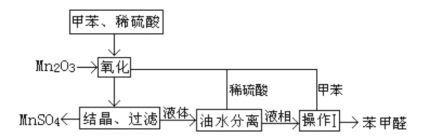
【题目】苯甲醛在医药、染料、香料等行业有着广泛的应用。实验室通过如图所示的流程由甲苯氧化制备苯甲醛。
试回答下列问题:
(1)Mn2O3氧化甲苯的反应需要不断搅拌,搅拌的作用是___。
(2)甲苯经氧化后得到的混合物通过结晶、过滤进行分离,该过程中需将混合物冷却,其目的___。
(3)实验过程中,可循环使用的物质分别为___,___。
(4)实验中分离甲苯和苯甲醛采用的操作I是___________。
(5)实验中发现,反应时间不同苯甲醛的产率也不同(数据见下表),
反应时间/h | 1 | 2 | 3 | 4 | 5 |
苯甲醛产率/% | 76.0 | 87.5 | 83.6 | 72.5 | 64.8 |
请结合苯甲醛的结构,分析当反应时间过长时,苯甲醛产率下降的原因___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaOH溶液滴定邻苯二甲酸氢钾(邻苯二甲酸氢钾H2A的Ka1=1.1×103 ,Ka2=3.9×106)溶液,混合溶液的相对导电能力变化曲线如图所示,其中b点为反应终点。下列叙述错误的是

A. 混合溶液的导电能力与离子浓度和种类有关
B. Na+与A2的导电能力之和大于HA的
C. b点的混合溶液pH=7
D. c点的混合溶液中,c(Na+)>c(K+)>c(OH)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数,下列说法正确的是( )
A.17g由H2S与PH3组成的混合气体中含有的质子数为9NA
B.90g果糖(C6H12O6,分子中无环状结构和碳碳双键)中含有的非极性键数目为3NA
C.1mol由乙醇与二甲醚(CH3-O-CH3)组成的混合物中含有的羟基数目为NA
D.已知![]() Ra→X+
Ra→X+![]() He,则0.5molX中含有的中子数为34NA
He,则0.5molX中含有的中子数为34NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列热化学方程式:
(1)CH3COOH(l)+2O2(g)= 2CO2(g)+2H2O(l) ΔH1=-870.3 kJ/mol
(2)C(s)+O2(g)= CO2(g) ΔH2=-393.5 kJ/mol
(3)H2(g)+![]() O2(g)= H2O(l) ΔH3=-285.8 kJ/mol
O2(g)= H2O(l) ΔH3=-285.8 kJ/mol
则反应2C(s)+2H2(g)+O2(g)= CH3COOH(l)的焓变为( ).
A.-488.3 kJ/molB.-244.15 kJ/molC.488.3 kJ/molD.244.15 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纳米级Fe3O4是一种非常重要的磁性材料,同时也可用作催化剂载体和微波吸收材料。納米级Fe3O4有多种不同制法,请回答下列相关问题。
I.下图是用共沉淀法制备纳米四氧化三铁的流程。
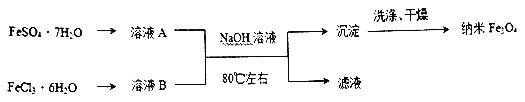
(1)除Fe3O4外铁的两种常见氧化物中在空气中性质比较稳定的是_______(填化学式),该物质的用途是___________(任写一种)。
(2)实验室保存溶液B 时为了防止出现浑浊通常采用的措施是___________ 。
(3)证明沉淀已经洗涤干净的操作是___________ 。
(4)写出该方法中发生的主要反应的离子方程式___________ 。
(5)实际生产中为提高产率,起始所用FeSO4·7H2O 和FeCl3·6H2O 的物质的量之比大于1:2,原因是___________。
II.制备纳米四氧化三铁的另一种流程如下图所示。
![]()
(6)写出第2 步反应的化学方程式______________,其中氧化产物和还原产物的物质的量之比为______。
(7)纳米Fe3O4投入分散剂中形成的分散系是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对各电解质溶液的分析不正确的是
A.硫酸氢钠溶液中:c(H+)=c(OH-)+c(SO42-)
B.向稀氨水中滴加稀盐酸至恰好中和:c(NH4+)<c(Cl-)
C.0.l mol·L-1 Na2S溶液中:c(S2-)+c(HS-)+c(H2S)=c(Na+)
D.向CH3COONa溶液中加适量蒸馏水:c(CH3COO-)与c(OH-)都减小,c(OH-)/c(CH3COO-)增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com