
【题目】已知下列热化学方程式:
(1)CH3COOH(l)+2O2(g)= 2CO2(g)+2H2O(l) ΔH1=-870.3 kJ/mol
(2)C(s)+O2(g)= CO2(g) ΔH2=-393.5 kJ/mol
(3)H2(g)+![]() O2(g)= H2O(l) ΔH3=-285.8 kJ/mol
O2(g)= H2O(l) ΔH3=-285.8 kJ/mol
则反应2C(s)+2H2(g)+O2(g)= CH3COOH(l)的焓变为( ).
A.-488.3 kJ/molB.-244.15 kJ/molC.488.3 kJ/molD.244.15 kJ/mol
 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案科目:高中化学 来源: 题型:
【题目】氯化铜晶体(CuCl2·2H2O)中含有FeCl2杂质,为制得纯净的氯化铜晶体,首先将其制成水溶液,再按下图所示的操作步骤进行提纯。

请参照下表给出的数据填空。
氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH | |
Cu2+ | 4.7 | 6.7 |
Fe2+ | 7.0 | 9.0 |
Fe3+ | 1.9 | 3.7 |
(1)操作I加入X的目的是_________________。
(2)下列物质都可以作为X,适合本实验的X物质可以是(填选项)_________ 。
A、KMnO4 B、NaClO C、H2O2 D、Cl2
(3)操作II的Y试剂为____________(填化学式),并调节溶液的pH在______范围。
(4)实验室在配制CuCl2溶液时需加入少许_________(填物质名称),理由是(文字叙述并用有关离子方程式表示)_________________ __________。
(5)若将CuCl2溶液蒸干灼烧,得到的固体是_________________(填化学式);若要得无水CuCl2,请简述操作方法_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学按图所示的装置进行电解实验 下列说法正确的是 ( )
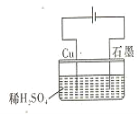
A.电解过程中,铜电极上有H2产生
B.电解初期,总反应方程式为:Cu+H2SO4 ![]() CuSO4+H2
CuSO4+H2
C.电解一段时间后,石墨电极上有O2产生
D.整个电解过程中,H+的浓度不断增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量的Fe和Fe2O3混合物投入250ml 2mol/L的HNO3溶液中,反应完全,无固体剩余,生成1.12L NO气体(标准状况),再向反应后的溶液中加入1mol/L的NaOH溶液,要使铁元素全部沉淀下来,所加入NaOH溶液的体积最少是 ( )
A.450mlB.500ml
C.400mlD.无法判断
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁是日常生活中最常见的金属,某班同学在学习铁的知识时,有下列问题:
问题1:铁为何称为黑色金属?
问题2:CuO在高温下可分解为 Cu2O和O2,Fe2O3在高温下可分解为FeO和O2吗?
(1)对于问题1,同学们上网查找,有两种解释:
A.因为在铁表面上有黑色的铁的氧化物,所以叫黑色金属
B.因为铁的粉末为黑色,铁的氧化物也均为黑色,所以叫黑色金属
①你认为正确的说法是__________。
②若有一黑色粉末,如何鉴别是铁粉,还是Fe3O4?______________________________________。
③若有一黑色粉末,为铁和四氧化三铁的混合物,如何证明其中有Fe3O4(只要求简述实验方法)?____________________________________。
(2)对于问题2,同学们准备实验探究,他们设想了两种方法:
A.将三氧化二铁高温灼烧,看灼烧前后颜色是否变化。
B.将三氧化二铁高温灼烧,看灼烧前后质量是否变化。
①实验中应将Fe2O3放在__________(填仪器名称)中灼烧。
②方法A中,如果高温灼烧后颜色由__________变为__________,说明Fe2O3确实发生了变化。能说明生成的一定为FeO吗?__________,理由是________________________。
③方法B中,如果发生了预期的反应,固体高温灼烧前后质量比应为________,但是,实验结果固体灼烧前后质量比为30∶29,则高温灼烧后生成物是____________________。
④比较两种方法,你认为较好的方法是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列各说法中,正确的是
A. 对于2SO2(g)+O2(g) ![]() 2SO3(g) ΔH=-Q kJ·mol-1,(Q>0),若反应中充入1mol SO2和足量的氧气反应时,放出的热量一定是Q/2 kJ
2SO3(g) ΔH=-Q kJ·mol-1,(Q>0),若反应中充入1mol SO2和足量的氧气反应时,放出的热量一定是Q/2 kJ
B. 热化学方程式中的化学计量数不能用分数表示
C. Zn(s)+H2SO4(aq) ===ZnSO4(aq)+H2(g) ΔH<0,该反应的化学能可以转化为电能
D. ΔH的大小与热化学方程式的化学计量数无关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列是实验室制取Cl2并以Cl2为原料进行特定反应的实验:

(1)A为氯气发生装置,写出反应的化学方程式_____________________.
(2)实验开始先点燃A处的酒精灯,打开旋塞K,让Cl2充满整个装置,再点燃D处的酒精灯.Cl2通入C瓶后进入D,D装置内盛有碳粉,发生氧化还原反应,生成CO2和HCl(气),试写出D装置中反应的化学方程式_______________.装置C的作用是________________.
(3)E处石蕊试液的现象是_____________,其原因是________________.
(4)若将E处溶液改为澄清石灰水,反应过程的现象是___________.
A.有白色沉淀生成 B.无白色沉淀生成
C.先生成白色沉淀,然后沉淀消失
(5)D处反应完毕后,关闭旋塞K,移去酒精灯,由于余热的作用,A处仍有少量Cl2产生,此时B中的现象是________________________________________.B的作用是___________________________________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是 ( )
A.氢镍碱性电池原理为H2+2NiO(OH)=2Ni(OH)2,则该电池负极反应式为:H2—2e—+2OH—=2H2O
B.在测定中和热的实验中,盐酸物质的量一般要大于氢氧化钠物质的量,这样才能保证氢氧化钠中和完全
C.已知2H2(g)+O2(g)=2H2O(g);△H=-483.6kJ/mol,则氢气的燃烧热为241.8kJ/mol
D.已知S(s)+O2(g)=SO2(g);△H1 S(g)+O2(g)=SO2(g);△H2,则△H1<△H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知在pH为4~5的溶液中,Cu2+几乎不水解,而Fe3+几乎完全水解。某学生拟用电解CuSO4溶液的方法测定铜的相对原子质量。其实验流程如下图所示:
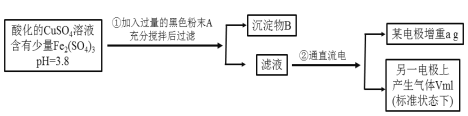
试回答下列问题:
(1)加入A的作用是___________________________。
(2)步骤②中所用部分仪器如图所示:II电极上发生的电极反应式为___________________。
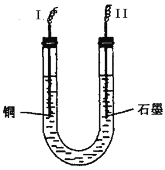
(3)步骤②的变化中,实现的能量转化形式是______________________。
(4)在进行测定铜的相对原子质量的实验操作中,属于不必要操作的是________。
a.称量电解前电极的质量
b.电解后电极在烘干前,必须用蒸馏水冲洗
c.小心刮下电解后电极上的铜,并清洗、称量
d.电极在烘干称重的操作中必须按:烘干→称重→再烘干→再称重,至少进行两次
e.在空气中烘干电极,必须采用低温烘干法
(5)铜的相对原子质量的计算式为________。
(6)假若电解后溶液呈无色,向其中滴加甲基橙试液,观察到的现象是_______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com