
【题目】氯化铜晶体(CuCl2·2H2O)中含有FeCl2杂质,为制得纯净的氯化铜晶体,首先将其制成水溶液,再按下图所示的操作步骤进行提纯。

请参照下表给出的数据填空。
氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH | |
Cu2+ | 4.7 | 6.7 |
Fe2+ | 7.0 | 9.0 |
Fe3+ | 1.9 | 3.7 |
(1)操作I加入X的目的是_________________。
(2)下列物质都可以作为X,适合本实验的X物质可以是(填选项)_________ 。
A、KMnO4 B、NaClO C、H2O2 D、Cl2
(3)操作II的Y试剂为____________(填化学式),并调节溶液的pH在______范围。
(4)实验室在配制CuCl2溶液时需加入少许_________(填物质名称),理由是(文字叙述并用有关离子方程式表示)_________________ __________。
(5)若将CuCl2溶液蒸干灼烧,得到的固体是_________________(填化学式);若要得无水CuCl2,请简述操作方法_________________________。
【答案】(1)加入氧化剂,使Fe2+氧化为Fe3+ (2)C、D
(3)CuO;3.7≤pH<4.7
(4)盐酸 Cu2+水解:Cu2++2H2O![]() Cu(OH)2+2H+ ,加入盐酸抑制其水解
Cu(OH)2+2H+ ,加入盐酸抑制其水解
(5)CuO,HCl气流中蒸发
【解析】
试题分析::1)分析流程和实验过程可知,操作Ⅰ加入X的目的是加入氧化剂,使Fe2+氧化成Fe3+;
(2)加入X的目的是氧化亚铁离子,加入的是氧化剂,能将Fe2+氧化为Fe3+,且易除去,除杂时,不能引入新的杂质,所以选项中:A.KMnO4 氧化剂加入会增加杂质离子,故A不符合:B.NaClO是氧化剂,但引入杂质钠离子,故B不符合;C.H2O2 做氧化剂没有增加新杂,故C符合;D.Cl2是氧化剂,反应过程中不引入新的杂质,故D符合;故答案为CD;
(3)分析图表数据结合题示,调节pH3.7~4.7,调节pH使Fe3+全部沉淀,同样不引进新杂质,所以Y最好为CuO或Cu(OH)2或CuCO3;
(4)CuCl2属于强酸弱碱盐,溶液中水解显酸性,加盐酸时抑制其水解,反应的离子方程式为:Cu2++2H2O![]() Cu(OH)2+2H+;
Cu(OH)2+2H+;
(5)CuCl2属于强酸弱碱盐,加热蒸发时促进其水解(HCl易挥发),生成Cu(OH)2沉淀,最后灼烧分解生成CuO,若要得到无水CuCl2,需要在HCl气氛中采用蒸发结晶的方法。


科目:高中化学 来源: 题型:
【题目】下列属于吸热反应是
A. 金属钠与水的反应 B. 盐酸与氢氧化钠的反应
C. 铝与氧化铁的铝热反应 D. NH4Cl晶体与Ba(OH)2·8H2O晶体反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁在工业、医疗等领域均有重要用途。某化学小组利用硼砂工厂的固体废弃物(主要含有MgCO3、MgSiO3、Al2O3和Fe2O3等),设计了回收其中镁的工艺流程:

(1)酸浸前,将固体废弃物研磨的目的是_______,为达到此目的,还可以采取的措施是_____(任写一条)。
(2)酸浸时,生成滤渣I的离子方程式为_________。
(3)第一次调节pH的目的是_____。当加入氨水使Al3+开始沉淀时,溶液中c(Fe3+)/c(Al3+)为 _________ 。已知Ksp[Fe(OH)3 ]=4×10-38,Ksp[Al(OH)3 ]=1×10-33.
(4)设计简单方案分离滤渣2,简述实验过程:______。
(5)滤液3中可回收利用的物质主要是_____(填化学式),其阳离子的电子式为 _______。
(6)写出工业上从滤渣3中获得镁锭的所有反应的化学方程式:_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质用途的说法错误的是
A. 明矾可用作净水剂
B. 氧化铝用于制造耐火坩埚
C. 碳酸钡可用作医疗上检查肠胃的“钡餐”
D. 常温下,可用铁制容器贮运浓硝酸、浓硫酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 (普通班做)
某温度时,在一个2L的密闭容器中,X、Y、Z三种气体物质的物质的量随时间的变化曲线如图所示。根据图中数据,试填写下列空白:

(1)该反应的化学方程式为 ;
(2)从开始至2min,Z的平均反应速率为 ;
平衡时,X的转化率为 ;平衡时,Y的浓度为 ;
(3)下列叙述能说明该反应已达到化学平衡状态的是(填标号) ;
A容器内压强不再发生变化
B X的体积分数不再发生变化
C容器内气体原子总数不再发生变化
D相同时间内消耗2n mol的Z的同时消耗n mol的Y
E. 相同时间内消耗n mol的Y的同时消耗3n mol的X
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】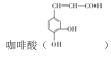 是制备某种抗肿瘤药物的重要原料。由甲苯制备咖啡酸的合成路线(部分反应条件略去)如图所示:
是制备某种抗肿瘤药物的重要原料。由甲苯制备咖啡酸的合成路线(部分反应条件略去)如图所示:

已知:
(1)咖啡酸的分子式为_____,含氧官能团有______。
(2)A的结构简式为_____,该分子的核磁共振氢谱峰面积之比为______。
(3)反应④的化学方程式为________,反应类型为_______。
(4)满足下列条件的咖啡酸的同分异构体有_____种。
①苯环上有三个取代基②1mol该物质能与2molNaHCO3反应。
(5)检验F中碳碳双键官能团的方法是_______。
(6)苯丙烯酸的结构简式为![]() ,根据提供信息ii,设计以甲苯和乙醛为原料制备苯丙烯酸的合成路线。_______
,根据提供信息ii,设计以甲苯和乙醛为原料制备苯丙烯酸的合成路线。_______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用已知浓度的烧碱溶液滴定未知浓度的盐酸,下列操作中正确的是
A. 碱式滴定管用蒸馏水洗净后,直接加入已知浓度的烧碱溶液
B. 锥形瓶用蒸馏水洗净后,直接加入一定体积的未知浓度的盐酸
C. 滴定时,没有逐出滴定管下口的气泡
D. 该实验中,某同学将消耗已知浓度的烧碱溶液的体积记录为 22.5 mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是某橙汁饮料包装袋上的说明:
品名 | 浓缩橙汁 |
配料 | 水、糖、鲜橙浓缩液、柠檬酸、维生素C、β-胡萝卜素、山梨酸钾等 |
鲜橙原汁含量 | ≥20% |
净含量 | 1.5L |
生产日期 | 标于瓶盖上 |
(1)配料中属于着色剂的是______________。
(2)该橙汁饮料__________(填“含有”或“不含”)防腐剂。
(3)上述各种配料中,国家对__________、_____________的含量进行严格规定加以控制。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com